
科目: 来源: 题型:
【题目】下列是4位同学在学习“化学反应速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
查看答案和解析>>
科目: 来源: 题型:
【题目】
物 质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
乙 醇 | -117.0 | 78.0 | 0.79 |
乙 酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) | —— | 338.0 | 1.84 |
某学生在实验室制取乙酸乙酯的主要步骤如下:
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液。
②按如图1所示连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10分钟
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置,等待分层.
④分离出乙酸乙酯层并洗涤、干燥。
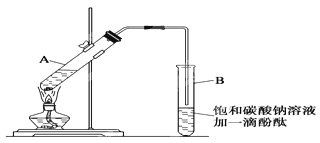
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为:______,写出制取乙酸乙酯的化学方程式:______.
(2)上述实验中饱和碳酸钠溶液的作用是:______(填字母)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于其分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是:______。
(4)指出步骤③所观察到的现象:______;分离出乙酸乙酯层后,一般用饱和食盐水和饱和氯化钙溶液洗涤,可通过洗涤除去______(填名称)杂质;为了干燥乙酸乙酯,可选用的干燥剂为______(填字母)。
A.P2O5B.无水Na2SO4C.碱石灰 D.NaOH固体
(5)某化学课外小组设计了如下图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与上图的装置相比,下图装置的主要优点有:____________、_________。(写出两条即可)

查看答案和解析>>
科目: 来源: 题型:
【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:
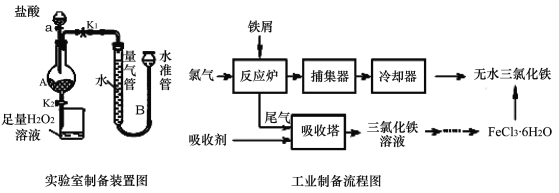
已知:(1)无水FeCl3熔点为555 K、沸点为588 K。
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当 时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。请回答:
(1)烧杯中足量的H2O2溶液的作用是 。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“……”的内容是 。
(3)从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入 后、 、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式: 。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为 。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c molL-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-)。样品中氯化铁的质量分数 ;
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F六种元素的原子序数依次递增。已知:
①F的原子序数为29,其余均为短周期主族元素;
②A的内层电子总数是最外层电子数的一半;
③C、E同主族且C原子最外层电子数是次外层电子数的3倍;
④D是金属性最强的短周期元素。完成下列问题
(1)F在元素周期表的位置______________。
(2)B、C、D、E的原子半径由小到大顺序是_________ (用元素符号表示)。
(3)已知D在C的单质中燃烧生成淡黄色的固体化合物甲,甲的化学式为_______________,电子式为_______,甲中的化学键类型为____________________。
(4)A的单质与E的最高价含氧酸反应的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法错误的是( )
A.18g冰的晶体中含有氢键的数目为2NA
B.11.2 L丙烷(标准状况)中含有σ键的数目为5NA
C.2.0 L 0.5 mol/L NaAlO2溶液中含有氧原子的数目为2NA
D.1molCl2与足量NaOH溶液反应,转移电子的数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某校研究性学习小组的同学设计了如图所示的实验装置(夹持及尾气处理装置未画出)来探究氨气的性质。A中是氯化铵和氢氧化钙固体,C中盛Wg固体氧化铜。实验时观察到C中CuO变为红色,D中无水CuSO4变蓝,同时生成一种无污染的气体。

回答下列问题:
(1)B中碱石灰的作用是____________。
(2)氨气与CuO反应的化学方程式为 。该反应中氨的作用是______(填氧化剂或还原剂)。
(3)有同学认为NH3与CuO反应生成的红色物质中可能含Cu2O。Cu2O在酸性溶液中Cu+歧化生成Cu和Cu2+。请设计一个简单的实验检验该红色物质中是否含有Cu2O 。
(4)若实验前后D装置的质量差为ag,则制得的铜的纯度为____________(用含a和 W的式子表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】铝热反应生成的铁常因其中含有铝而形成合金。一定质量的铁铝合金溶于足量的NaOH溶液中,完全反应后产生6.72 L(标准状况下)气体;用同样质量的铁铝合金完全溶于足量的盐酸中,在标准状况下产生11.2 L气体。则该合金中铝、铁的物质的量之比为
A.1︰1 B.2︰5 C.3︰2 D.3︰5
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)用正确的序号填空: ①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3 ;
互为同位素的是 ; 互为同素异形体的是 ;
互为同分异构体的是 ; 互为同系物的是
(2)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不 断溶解 | C的质 量增加 | A上有气 体产生 |
根据实验现象回答下列问题:
①装置甲中作正极的是_____ ___ (填“A”或“B”)。
②装置乙溶液中Cu2+向_____ __极移动(填“B”或“C”)。
③装置丙中金属A上电极反应属于___ ___(填“氧化反应”或“还原反应”)。
④四种金属活动性由强到弱的顺序是____ ___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com