
科目: 来源: 题型:
【题目】防冻剂是一种能在低温下防止物料中水分结冰的物质.下列可用于防冻剂的物质中,含有氮元素的有机物是( )
A.甲醇[CH3OH] B.氯化钙[CaCl2]
C.尿素[CO(NH2)2] D.亚硝酸钠[NaNO2]
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述错误的是
A.10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49%
B.地球上99%的溴蕴藏在大海中,故溴被称为“海洋元素”
C.在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水
D.向两等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)实验室需要450 mL 0.02 mol/L酸性KMnO4标准溶液,现有仪器:
① 托盘天平 ② 玻璃棒 ③ 药匙 ④ 200mL烧杯 ⑤ 量筒,还需要 玻璃仪器才能完成配制,需称量KMnO4固体 g。
(2)下列操作会使配制的KMnO4溶液浓度偏大的是 (填写编号,假设其他操作均正确)。
A.没有冷却至室温就转移液体到容量瓶并完成定容 |
B.使用容量瓶配制溶液,定容时,俯视刻度线 |
C.没有用蒸馏水洗涤烧杯2-3次,并将溶液移入容量瓶中 |
D.容量瓶刚用蒸馏水洗净,没有烘干就用来配制溶液 |
E.定容时,滴加蒸馏水,不慎液面略高于刻度线,吸出少量水使凹液面最低点与刻度线相切
(3)配平下面的方程式(将有关的化学计量数填入答题卡的横线上):
□KMnO4+□H2C2O4+□H2SO4——□MnSO4+□K2SO4+□H2O+□CO2↑
(4)人体血液里Ca2+的浓度一般以mg/cm3为单位。为测定血液样品中Ca2+的浓度,抽取血样20.00 mL,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用上述标准0.02 mol/L 酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗13.00 mL酸性 KMnO4溶液,请计算血液样品中Ca2+的浓度为_________mg/cm3(保留到小数点后两位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol-1,甲醚可作燃料电池的燃料。
(1) 写出甲醚燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应4C(s)+ 6H2(g)+ O2(g)== 2CH3OCH3(g)的反应热为 ;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+ 2CO2(g)![]() CH3OCH3(g)+ 3H2O(g) △H<0
CH3OCH3(g)+ 3H2O(g) △H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应。下列能判断反应达到化学平衡状态的是 (选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将 (填“变大”、“变小”或“不变”)。
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式的其中一个产物是CO32-,请写出该反应的负极反应式 ;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500 mL NaCl溶液,装置如图所示:

请写出电解过程中Y电极附近观察到的现象是 ;当燃料电池消耗2.8 LO2(标准状况下)时,计算此时:NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
科目: 来源: 题型:
【题目】元素X的原子有3个电子层,最外层有4个电子。这种元素位于周期表的
A. 第4周期ⅢA族 B. 第4周期ⅦA族
C. 第3周期ⅣB族 D. 第3周期ⅣA族
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是合成硝酸、铵盐和氮肥的基本原料,氮的氧化物是大气的污染物,请问:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 molL-1的氨水中加入少量的NH4Cl固体,溶液的pH (填“增大”或“减小”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(3)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式: 。在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表示物质结构的化学用语或模型正确的是( )
A.NaH中氢离子结构示意图:![]()
B.CH4分子的球棍模型:![]()
C.醛基的电子式:![]()
D.对﹣硝基甲苯的结构简式:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)===2H2O(1) ΔH=-572 kJ·mol-1。请回答下列问题:
(1)生成物能量总和________(填“大于”“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气燃烧生成水蒸气,则放出的热量________(填“大于”“小于”或“等于”)572 kJ。
(3)H2的标准燃烧热ΔH=________。
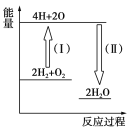
(4)反应2H2+O2![]() 2H2O的能量变化如图所示。
2H2O的能量变化如图所示。
已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。
则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com