
科目: 来源: 题型:
【题目】某无色溶液,只可能含有以下离子中的若干种(忽略水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+、NO3一、CO32一、SO42-,现取三份100 mL溶液进行如下实验:
① 第一份加足量AgNO3溶液后,有白色沉淀产生;
② 第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为4.66 g;
③ 第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如下图。
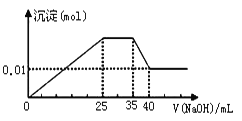
根据上述实验,以下推测不正确的是( )
A.依据电荷守恒,原溶液中NO3-的物质的量应为0.03 mol
B.原溶液一定不存在H+、Fe3+、CO32-
C.原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+)∶n(Al3+)∶n( NH4+) = 1∶1∶2
D.实验所加的NaOH的浓度为2 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
(1)写出下列元素的符号:A B C D
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是 ,碱性最强的是 .
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是 ,电负性最大的元素是 .
(4)D的氢化物比C的氢化物的沸点 (填“高“或“低“),原因
(5)E元素原子的核电荷数是 ,E元素在周期表的位置 .
(6)A、B、C最高价氧化物的晶体类型是分别是 晶体、 晶体、 晶体
(7)画出D原子的核外电子轨道表示式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是
A.80mL10mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4 NA
B.标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数为1.5 NA
C.7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA
D.将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于镁的性质叙述正确的是( )
A.能在空气中燃烧,但不能在二氧化碳中燃烧
B.不能与氮气发生反应
C.不与冷水反应,但与热水反应
D.可用电解氯化镁溶液的方法来制取
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开) 1mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能: P-P 198 kJ.mol-1、P-O 360 kJ.mol-1、氧气分子内氧原子间的键能为498 kJ.mol-1 。则P4+3O2 =P4O6的反应热H为
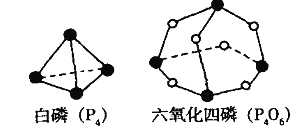
A.+1638 kJ.mol-1 B.-1638 kJ.mol-1
C.-126 kJ.mol-1 D.+126 kJ.mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点﹣129℃;可在铜的催化作用下由F2和过量NH3反应得到.
(1)写出制备 NF3的化学反应方程式: .
(2)NF3的沸点比NH3的沸点(﹣33℃)低得多的主要原因是 .
(3)NF3中N元素采取 方式杂化.
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为 其中心离子是,配位数为 .
(5)已知氧族元素(氧O、硫S、硒Se、碲Te),工业上可用Al2Te3来制备H2Te,完成下列化学方程式:
Al2Te3+ ═ Al(OH)3↓+ H2Te↑
(6)已知在常温下,生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式 .
(7)如图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,△H为相同物质的量的单质与H2反应的反应热.则:b代表 ,d代表 (均写单质名称).
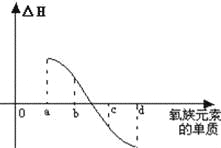
查看答案和解析>>
科目: 来源: 题型:
【题目】在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成
水煤气,化学反应方程式为 。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反
应如下:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
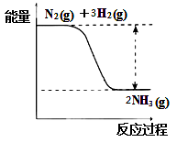
①合成氨的反应中的能量变化如右图所示。
该反应是 反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量 (填“大于”或“小于”)生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述不能说明该反应达到平衡状态的是 (填序号)。
A.容器中混合气体的密度不随时间变化
B.单位时间内断裂3 mol H-H键的同时断裂6 mol N-H键
C. N2 、H2 、NH3的物质的量之比为1:3:2
D.容器中混合气体的平均相对分子质量不随时间变化
(3)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)
+3H2(g)![]() CH3OH(g)+H2O(g),在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
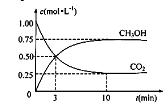
①从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)= 。
②达平衡时容器内平衡时与起始时的压强之比 。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学﹣﹣选修物质结构与性质]
下表为长式周期表的一部分,其中的序号代表对应的元素.

(1)写出上表中元素⑨原子的外围电子排布式 .
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为 杂化;元素⑦与⑧形成的化合物的晶体类型是 .
(3)元素④的第一电离能 > ⑤(填写“>”、“=”或“<”)的第一电离能;元素④与元素①形成的X分子的空间构型为 .请写出与元素④的单质互为等电子体分子、离子的化学式 (各写一种).
(4)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是 .
(5)④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为 .
(6)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,反应的离子方程式为 ;元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则一个晶胞中所包含的氧原子数目为 .

查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8mol NO2,发生如下反应:2NO2(红棕色)N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:
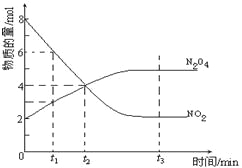
(1)在该温度下,反应的化学平衡常数表达式为:
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: molL﹣1s﹣1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率.
查看答案和解析>>
科目: 来源: 题型:
【题目】按如图所示装置进行实验,并回答下列问题:
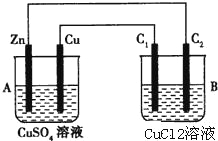
(1)判断装置的名称:A池为 ,B池为 .
(2)锌棒上发生 反应,电极反应式为 ;铜棒上的现象是 ,电极反应式为 ;石墨棒C1上发生的电极反应式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com