
科目: 来源: 题型:
【题目】C、H、N三种化学元素在组成人体的化学成分中,质量分数共占74%左右,而这三种元素在岩石圈中,其质量分数不到1%。这个事实说明
A. 生物界与非生物界的统一性 B. 生物界与非生物界的差异性
C. 元素在无机自然界中都可找到 D. 生物界的特殊性
查看答案和解析>>
科目: 来源: 题型:
【题目】现有反应:mA(g)+nB(g) ![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为 热反应,且m+n p(填“>”“=”“<”)。
(2)减压使容器体积增大时,A的质量分数 (填“增大”“减小”或“不变”,下同)
(3)若加入B(维持体积不变),则A的转化率 。
(4)若升高温度,则平衡时B、C的浓度之比将 。
(5)若加入催化剂,平衡时气体混合物的总物质的量 。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色 ,而维持容器内压强不变,充入氖气时,再次建立平衡时与原平衡相比,气体混合物颜色 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式____________________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)==2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)== N2(g)+2H2O (g);△H= -534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式_____________。
(5)已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-543kJ/mol
1/2H2(g)+1/2F2(g)=HF(g) △H=-269kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H=-242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:
______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.他们只利用Al、 Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L).设计实验方案来研究影响反应速率的因素。
实验一:甲同学研究的实验报告如下表:

(1)该同学的实验目的是__________________
要得出正确的实验结论,还需控制的实验条件是_____________。
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验

(2)乙同学在实验中应该测定的数据是_____________________。
(3)乙同学完成该实验应选用的实验药品是________________;
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是_____________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入________。
A.硫酸钾 B.硫酸锰 C.氯化钾 D.水
查看答案和解析>>
科目: 来源: 题型:
【题目】计算题:将等物质的量的A 和B混合于2L密闭容器中,发生下列反应:
3A(g)+B(g)=xC(g)+2D(g),4min后测得c(D)=0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.125mol/(L·min),求:(1)x的值是多少?(2)此时A的物质的量浓度?(3)B的平均反应速率?
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计如下实验方案以分离KCl和BaCl2两种固体混合物,供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、硫酸、盐酸

(1)操作①的名称是 ,操作②的名称是 。
(2)试剂a是 ,试剂b是 (填化学式)。
(3)加入试剂b所发生反应的离子方程式为 。
(4)该方案能否达到实验目的(填能或不能) .若不能,应如何改进(若能,此问不用回答) 。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是 。
A.固体C的质量 | B.沉淀A的质量 |
C.沉淀A1的质量(未干燥) | D.固体B的质量 |
查看答案和解析>>
科目: 来源: 题型:
【题目】
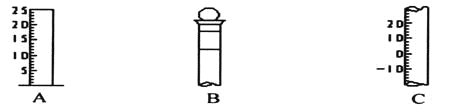
(1)请写出下列仪器的名称:A ,B ,C 。
(2)仪器B上标记有 (填序号)。
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
Ⅱ.现用98%的浓H2SO4(密度为1.84g/cm3)来配制480mL0.2mol/L的稀H2SO4。
有关操作为:①计算所需浓硫酸的体积 ②量取一定体积的浓硫酸 ③稀释、冷却 ④转移、洗涤 ⑤定容 ⑥摇匀。回答下列问题
(3)应用量筒量取的浓硫酸体积是 mL,实验中所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外还有 。
(4)第③步中稀释浓硫酸的操作是 。
(5)将所配制的稀H2SO4进行测定,发现实际浓度大于0.2mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母) 。
A.用量筒量取浓硫酸时,仰视量筒的刻度 |
B.容量瓶未干燥即用来配制溶液 |
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容 |
D.往容量瓶转移时,有少量液体溅出 |
E.烧杯未进行洗涤
F.在容量瓶中定容时俯视容量瓶刻度线
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJ/mol
O2(g)=H2O(l) △H=-285.8kJ/mol
CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ/mol
O2(g)=CO2(g) △H=-283.0kJ/mol
C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) △H=-5518kJ/mol
O2(g)=8CO2(g)+9H2O(l) △H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是( )
A. H2(g) B. CO(g)
C. C8H18(l) D. CH4(g)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1451.6kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ/mol
(1)写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式_______________
(2)某小组根据甲醇燃烧的反应原理,设计如图所示的电池装置:
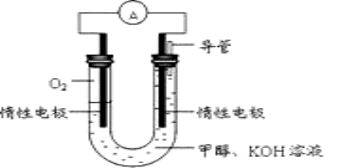
该电池正极的电极反应式____________________
工作一段时间后,测得溶液的pH______________(填增大、减小或不变),则该电池总反应的离子方程式__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中不属于氧化还原反应的是
A.3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O
B.3Cl2+6KOH=5KCl+KClO3+3H2O
C.3CCl4+K2Cr2O7=2CrO2C12+3COCl2+2KCl
D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com