
科目: 来源: 题型:
【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3 (aq)+S(s)![]() Na2S2O3 (aq)
Na2S2O3 (aq)
实验步骤:
① 称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。 另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
② 安装实验装置(如图所示,部分夹持装置略去),水浴加热, 微沸60分钟。

③ 趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、低温干燥,得到产品。
回答问题:
(1) Na2S2O3 中硫元素的化合价为_____________;Na2S2O3在强酸性溶液中不能稳定存在,其原因为___________________(用离子方程式表示)。
(2)仪器a的名称是________,其作用是________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是________。检验其是否存在的方法是___________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂, 用0.100 0 mol·L-1碘的标准溶液滴定(反应原理为:2S2O![]() +I2===S4O
+I2===S4O![]() +2I-)。
+2I-)。
(4)滴定至终点时,溶液颜色的变化:_____________。
(5)滴定结束后消耗碘的标准溶液体积为20.00mL。产品的纯度为(用含W的代数式表示)_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了证明醋酸是弱电解质,四同学分别进行实验:甲用pH试纸测出0.10 mol/L的醋酸溶液pH = 4;乙将pH = 3醋酸和盐酸,各取10 mL,用蒸馏水稀释到原来的100倍,然后用pH试纸测定该溶液的pH,醋酸的变化小;丙将pH = 3醋酸和盐酸,分别加入相应的钠盐固体,醋酸的pH变化大;丁取pH = 3醋酸和盐酸,分别稀释到原来的100倍,然后加入完全一样的锌粒,测量醋酸放出H2的速率快。
A.一位同学 B.二位同学 C.三位同学 D.四位同学
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 高纯度的晶体硅可以制备晶体管等半导体、电脑芯片和光导纤维
B. PM 2.5是指大气中直径接近2.5×10-6 m的颗粒物,它分散在空气中形成胶体
C. 受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理
D. NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
查看答案和解析>>
科目: 来源: 题型:
【题目】人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学
技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
电子表和电子计算器中所用的是纽扣式微型银锌电池,其电极分别为Ag2O和Zn,电解质为KOH溶液,工作时电池总反应为Ag2O+Zn+H2O===2Ag+Zn(OH)2。
①工作时电流从________极流向________极(填“Ag2O”或“Zn”)。
②电极反应式:正极:_____________________,负极:_____________________。
③工作时电池正极区的pH________(填“增大”、“减小”或“不变”)。氢镍电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是![]() H2+NiO(OH)
H2+NiO(OH) ![]() Ni(OH)2。
Ni(OH)2。
电池放电时, 负极的电极反应式为_________,正极的电极反应式为________________,正极附近溶液的pH__________(填“增大”,“减小”或者“不变”)
查看答案和解析>>
科目: 来源: 题型:
【题目】向10.0 mL 0.10 mol/L氨水中滴入0.10 mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出)。下列有关叙述正确的是( )

A.M~N间一定存在:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.M点对应的盐酸体积为10.0mL
C.pH=7的溶液中:c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.P点处的溶液中存在:2c(NH4+)+2c(NH3·H2O)=c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】据《参考消息》报道,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。
(1)晶体硅在氧气中燃烧的热化学方程式为Si(s)+ O2(g)═ SiO2(s) ΔH = -989.2 kJmol-1,有关键能数据如下表:
化学键 | Si-O | O═O | Si-Si |
键能 / kJmol-1 | x | 498.8 | 176 |
已知1 mol Si中含2 mol Si-Si键,1 mol SiO2中含4 mol Si-O键,则x的值为__________。
(2)假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥当的是______________。
A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B.硅的来源丰富,易于开采,且可再生
C.硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D.寻找高效新催化剂,可以使反应SiO2 + 2 C![]() Si + 2 CO ↑在常温下发生,是硅能源开发利用的关键技术
Si + 2 CO ↑在常温下发生,是硅能源开发利用的关键技术
(3)工业制备纯硅的反应为2 H2(g)+ SiCl4(g)═ Si(s)+ 4 HCl(g) ΔH = + 240.4 kJmol-1,生成的HCl通入100 mL 1 molL-1的NaOH溶液恰好完全被吸收,则上述制备纯硅的反应过程中__________(填“吸收”或“释放”)的热量为__________kJ。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流表。
锌片上发生的电极反应:__________________;银片上发生的电极反应:_________________。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况)___________L;
②通过导线的电量________C。(已知NA=6.02×1023mol-1,电子电荷为1.60×10-19C)
查看答案和解析>>
科目: 来源: 题型:
【题目】碳及其含碳化合物在人们的生产生活中应用广泛。
(1)将不同量的CO2(g)和H2(g)分别通入到体积为2L的恒容密闭容器中,进行反应2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g),得到如表三组数据;
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
CO2 | H2 | H2 | C2H5OH | |||
1 | 650 | 2 | 6.8 | 2.0 | 0.8 | 6 |
2 | 900 | 2 | 4.4 | 2.0 | 0.4 | 3 |
3 | 900 | 4 | 8.8 | C | d | t |
①实验1中以v(H2)表示的反应速率为________________
②已知在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数称之为化学平衡常数。900℃化学平衡常数为______________,
③如果改变影响平衡的条件之一(如温度,压强,反应物的浓度)平衡将向着能够减弱这种改变的方向移动。则第3组与第2组相比CO2的转化率___________(填“增大”“减小”“不变” 不能确定).
(2)将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒). 持续通入甲烷,在标准状况下,消耗甲烷体积VL.
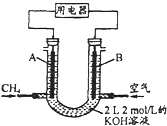
①0<V![]() 44.8L时,负极电极反应为_________________
44.8L时,负极电极反应为_________________
②44.8L<V![]() 89.6L时,电池总反应方程式为_____________
89.6L时,电池总反应方程式为_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作中错误的是( )
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C. 蒸发结晶时应将溶液蒸干
D. 称量时,称量物放在称量纸上置于托盘天平的左盘,砝码放在托盘天平的右盘中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com