
科目: 来源: 题型:
【题目】I.明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质,可利用明矾石制备氢氧化铝。
(1)已知明矾石脱水后要硫化,化学方程式为2Al2(SO4)3+3S![]() 2Al2O3+9SO2,该反应的氧化剂与还原剂的物质的量之比是___________;若生成1 mol Al2O3,则转移的电子数为________。
2Al2O3+9SO2,该反应的氧化剂与还原剂的物质的量之比是___________;若生成1 mol Al2O3,则转移的电子数为________。
(2)证明废渣中含有Fe2O3 的化学方法:_____________________。
II.镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为:Mg17Al12 + 17H2=17MgH2 + 12Al ,得到的混合物Y(17MgH2 +12Al)在一定条件下可释放出氢气。
(3)熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是_____________________
(4)在6.0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17Al12 完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2的物质的量为_______mol。(已知:MgH2 + 2HCl = MgCl2 + 2H2↑)
查看答案和解析>>
科目: 来源: 题型:
【题目】原子核磁共振谱(NMR)是研究有机化合物结构的有力手段之一,在所研究化合物的分子中,每一结构中的等性氢原子,在NMR谱中都给出了相应的峰(信号),谱中峰的强度与结构中的氢原子数成正比。例如,乙醛的结构式为 ,其NMR中有两个峰,强度之比为3∶1。
,其NMR中有两个峰,强度之比为3∶1。
(1)结构简式为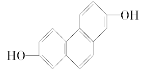 的有机物,在NMR上观察峰的强度之比为________________。
的有机物,在NMR上观察峰的强度之比为________________。
(2)实践中可根据NMR上观察到的氢原子给出的峰值情况,确定有机物的结构。如分子式为C3H6O2的链状有机物,其NMR上峰给出的稳定强度仅有4种,它们分别为:①3∶3;②3∶2∶1;③3∶1∶1∶1;④2∶2∶1∶1,请分别推断出其对应的全部结构:
①________________________________,
②________________________________,
③________________________________,
④________________________________。
(3)测得化合物CH3CH2CH2CH3的NMR上可观察到两种峰,而测得CHCH3CHCH3时,却得到氢原子给出的信号峰4个,结合其空间结构解释产生4个信号峰的原因:_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E五种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为短周期中原子半径最大的主族元素;E的原子序数为22。
(1)①E被称为“国防金属”和“生物金属”,是重要的结构材料。E原子基态的外围核外电子排布式为 ;
②金红石(EO2)的熔点1825℃,用熔盐法直接电解金红石可获得金属E,金红石所属的晶体类型是 晶体;
③ECl4能与NH4Cl反应生成配合物(NH4)2[ECl6]。此配合物中,形成配位键时提供孤对电子的有 (填元素符号)。与NH4+互为等电子体的一种阴离子为 (填化学式),其中心原子杂化类型为 杂化。
(2)在A、B、C三种元素中,电负性由小到大的顺序是 (用元素符号回答)。
(3)元素A的简单气态氢化物的沸点 (“高于”,“低于”)元素B的简单气态氢化物的沸点,其主要原因是 。
(4)由B形成的离子B3-与AC2互为等电子体,则B3-的
分子构型为 。
(5)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
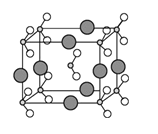
查看答案和解析>>
科目: 来源: 题型:
【题目】利用二氧化碳废气生产化工产品是解决室温效应的有效途径之一,对用二氧化碳为主要原料生产的四种产品(如下图所示)的相关说法不正确的是
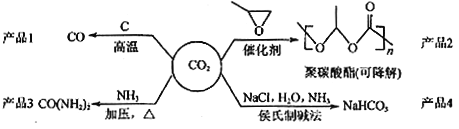
A.反应CO2(g)+C(s)=2CO(g)的△H>0,△S>0
B.用聚碳酸酯代替聚乙烯等传统塑料,可消除白色污染
C.CO(NH2)2与NH4CNO互为同分异构体,两者化学性质相同
D.侯氏制碱法的工艺过程中应用了物质溶解度的差异
查看答案和解析>>
科目: 来源: 题型:
【题目】 将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的是( )
A.①③⑤⑦⑧ B.②④⑦ C.①⑥ D.②④⑥⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】 在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)![]() 1/2 N2(g)+CO2(g);ΔH=-373.2kJ·mol-1达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
1/2 N2(g)+CO2(g);ΔH=-373.2kJ·mol-1达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时减小压强
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 人类在远古时代就通过燃烧植物的方式开始利用生物质能
B. 氢能是理想的绿色能源,但人们只能将氢气的化学能转化为热能
C. 煤中含有硫元素,大量的直接燃烧煤会引起酸雨等环境问题
D. 太阳能以光和热的形式传送到地面,人们可以直接利用这些光和热
查看答案和解析>>
科目: 来源: 题型:
【题目】5mL 0.4mol/LAgNO3与10mL0.3mol/LBaCl2溶液混合,溶液中离子浓度最大的是
A. NO3- B. Ba2+ C. Cl- D. Ag+
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F元素是原子序数依次增大的六种短周期元素。已知:元素A的原子半径在所有元素中最小,元素B的一种同位素可测定文物年代,D原子最外层电子数与核外电子总数之比为3∶4,E和D可以形成原子个数比为1∶1和 2∶1的两种离子化合物,F是同周期中简单离子中半径最小的元素。据此回答下列问题。
(1) F元素的原子结构示意图为________________,E在元素周期表中的位置为_______________。
(2) C元素与A元素形成一种离子CA![]() ,请写出检验溶液中存在该离子的实验操作、现象和结论: _____ ____。
,请写出检验溶液中存在该离子的实验操作、现象和结论: _____ ____。
(3) 写出F元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:___________________。
(4) 由以上某些元素组成的化合物X、Y、Z、W有如下转化关系(已知:Y和Z在水溶液中存在微粒种类相同)。
![]()
① X化合物中含有的化学键类型有__________________________;
② X+Z→Y的离子方程式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com