
科目: 来源: 题型:
【题目】从人类社会发展的长远前途看,对能源利用最好的办法是( )
A.大力勘探和开采石油
B.多利用天然气少使用石油
C.因为煤的储量比石油丰富,应多使用煤作能源
D.大力发展核能、氢能并充分利用太阳能
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
已知:

物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
(1)步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是_________________(只要求写出一种)。
(2)步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是________________。
(3)结合流程及相关数据分析,步骤V中加入铝粉的目的是________________。
(4)称取含Fe2O3和Al2O3的试样0.2000g,将其溶解在pH=2.0的热溶液中(50℃左右),以磺基水杨酸为指示剂,用0.02000 mol/L EDTA标准溶液滴定试样中的Fe3+,用去18.00 mL。然后将试液调至pH=3.5,加入上述EDTA标准溶液25.00 mL,并加热煮沸,使Al3+与EDTA完全反应,再调试液pH=4.5,以PAN(1-(2-吡啶偶氨)-2-萘酚)为指示剂,趁热用CuSO4标准溶液(每毫升含CuSO4·5H2O 0.005000g)返滴定,用去8.00 mL。计算试样中Fe2O3和Al2O3的质量分数。________________(写出计算过程)
(已知:EDTA与Fe3+、Al3+、Cu2+均按物质的量之比1∶1进行反应)
查看答案和解析>>
科目: 来源: 题型:
【题目】设阿伏加德罗常数为NA,则下列说法正确的是
A.15g甲基(-CH3)所含有的电子数是9NA
B.7.8g ![]() 中含有的碳碳双键数为0.3NA
中含有的碳碳双键数为0.3NA
C.1mol C2H5OH和1mol CH3CO18OH反应生成水的中子数为8NA
D.标准状况下,11.2L己烷所含分子数为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。

把与下面的元素有关性质相符的曲线的标号填入相应括号中:
①第IIA族元素的最外层电子数_____________。
②第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径_______。
③第二、三周期主族元素随原子序数递增原子半径的变化___________。
(2)已知某单核粒子的结构示意图为:![]()
①当x-y=10时,该粒子为______(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,若该微粒的氧化性很弱,得一个电子后变为原子,该微粒的符号是_______。
(3)已知A、B、C、D是中学化学中常见的四种10电子微粒,它们之间存在如图中转化关系。

请写出:A的化学式_______(写一种);D的化学式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)根据要求回答下列问题:
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He
(1)含有共价键的离子化合物是(用序号回答) ,含有共价键的共价化合物是(用序号回答) 。
(2)当其熔化时,不破坏化学键的是(用序号回答) 。
(二)写出下列物质或微粒的电子式:
H2O: Na2O: CO2:
查看答案和解析>>
科目: 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
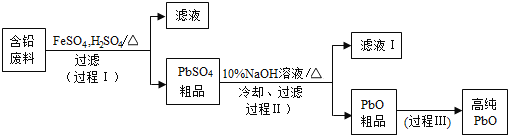
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是_________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++PbO2+4H++SO42-═2Fe3++PbSO4+2H2O
ii:……
①写出ii的离子方程式:______________________。
②下列实验方案可验证上述催化过程.将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.____________。
(3)PbO溶解在NaOH溶液中,其溶解度曲线如图1所示。

①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是___(选填序号)。
A.减小PbO的损失,提高产品的产率
B.重复利用NaOH,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过程Ⅲ的目的是提纯,结合上述溶解度曲线,简述过程Ⅲ的操作:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于胶体和溶液的说法正确的是
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在1~100nm之间
B.溶液呈电中性,胶体带有电荷
C.溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸
D.制备氢氧化铁胶体时,可以将饱和FeCl3溶液滴入沸水,然后长时间煮沸
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,正确的是
A.一定状况下,N2的摩尔体积可能恰好为11.2L/mol
B.在标准状况下1molN2的体积是22.4L/mol
C.1molN2的体积约是22.4L,则N2的温度和压强一定是标准状况
D.在标准状况下H2O的摩尔体积约是22.4L/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作和数据记录都正确的是
A. 用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.60 mL
B. 用标准NaOH溶液滴定未知浓度盐酸,用去NaOH溶液20.50mL
C. 用10 mL量筒量取8.25 mL盐酸
D. 用pH试纸测得某溶液pH为3.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com