
科目: 来源: 题型:
【题目】下列溶液一定是酸性的是
A.pH=6的某电解质的溶液 B.c(H+) > 1×10-7mol/L
C.溶液中含有H+ D.溶液中c(OH-) < c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】现有反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的 ( )
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(molL﹣1) | V/mL | c/(molL﹣1) | V/mL | ||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列反应中,属于氧化还原反应,且水既不作氧化剂又不作还原剂的是
A.2Na+2H2O=2NaOH+H2↑
B.2F2+2H2O=4HF+O2↑
C.CaO+H2O=Ca(OH)2
D.Cl2+H2O=HCl+HClO
查看答案和解析>>
科目: 来源: 题型:
【题目】298K时,在20.0ml0.10mol/L氨水中滴入0.10mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol/L氨水的电离度为1.32%,下列有关叙述不正确的是
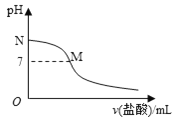
A.该滴定过程应该选择甲基橙作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
D.N点处的溶液中pH<13
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1 molL-1 AlCl3溶液中含有的Al3+数目小于NA
B. 标准状况下,11 g![]() H2
H2![]() O中含有的质子数目为6NA
O中含有的质子数目为6NA
C. 1 mol Li2O和Na2O2的混合物中含有的离子总数大于3NA
D. 常温常压下,4.6 g NO2所含的氮原子数目为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用下述装置制取氯气,并用氯气进行下列实验。看图回答下列问题:

(1)A、B两仪器的名称:A________,B________。
(2)洗气装置C是为了除去Cl2中的HCl气体,D是为了干燥Cl2,则C、D中应分别放入下列溶液中的C______________;D______________。
①NaOH溶液 ②饱和食盐水 ③AgNO3溶液 ④浓H2SO4
(3)E 中为红色干布条,F 中为红色湿布条,可观察到的现象是_______________。
(4)G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成____________。反应的离子方程式是________________,H是浸有NaBr溶液的棉花球,H处现象是棉花球表面变成________。
(5)P处为尾气吸收装置,可选用下列装置中的 ____________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】某课外小组设计了下图所示的实验装置(图中固定装置已略去),进行SO2性质的研究。
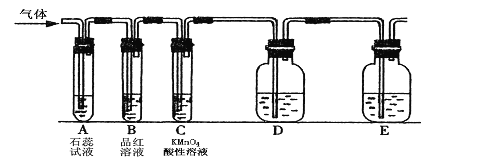
(1)从物质分类的角度,SO2属于________(填“酸性”或“碱性”)氧化物。写出硫酸型酸雨形成的反应方程式: _______ ,_____ 。
(2)图中D装置可用来验证SO2具有该性质,其中所加入的试剂是 _____。
(3)当向该装置通入SO2时,A中紫色石蕊溶液变红,用化学用语解释其原因是 ______ 。
(4)从元素化合价的角度分析,SO2的性质。
①当向该装置通入SO2一段时间后,可观察C中溶液褪色,MnO4-转化为Mn2+,说明SO2具
有______性,反应的离子方程式为 _________。
②如验证SO2还具有另一方面的性质,可选择的药品是__________。
A.过氧化氢 B.浓硫酸 C.氯水 D.硫化钠溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。其中一种方法是还原沉淀法,该法的工艺流程为:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O。下列有关说法正确的是
Cr2O72-(橙色)+H2O。下列有关说法正确的是
A.第①步当2v(Cr2O72)=v(CrO42-)时,达到了平衡状态
B.对于上述平衡,加人适量稀硫酸后,溶液颜色变黄色,则有利于 CrO42-的生成
C.第②步中,还原 0.1molCr2O72-需要45.6gFeSO4
D.第③步沉淀剂a可以使用NaOH等碱性物质
查看答案和解析>>
科目: 来源: 题型:
【题目】碲(Te)为第VIA元素.其单质和化合物在化工生产等方面具有重要应用。
(1)TeO2微溶于水,易溶于较浓的强酸和强碱。与盐酸反应时生成四氯化碲,其化学方程式为________________。
(2)25℃时;亚碲酸(H2TeO3)的 Ka1=1×10-3,Ka2=2×10-8。该温度下,0.1mol·L-1 H2TeO3的电离度α约为______________(α=![]() ×100%);NaHTeO3溶液的pH__________7(填“ >”、“<”或“=”)。
×100%);NaHTeO3溶液的pH__________7(填“ >”、“<”或“=”)。
(3)工业上常用铜阳极泥(主要成分为Cn2Te,还含有少量的Ag、Au)为原料制备单质碲,其工艺流程如下:
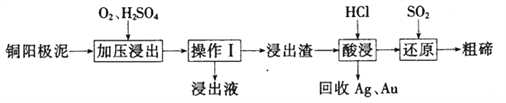
①实验室进行操作I时,下列仪器与该实验操作无关的为__________(填选项字母)。
A.长颈漏斗 B.烧杯 C.锥形瓶 D .玻璃棒
②已知‘浸出渣”的主要成分为TeO2。“加压浸出”时控制溶液pH为4.5~5.0,酸性不能过强的原因为_______________;“加压浸出”过程的离子方程式为______________________。
③“酸浸”后将SO2通入浸出液即可制得单质碲,则生成碲的化学方程式为________________。
④工业上还可以将铜阳极泥煅烧、碱浸后得到Na2TeO3,然后通过电解的方法得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com