
科目: 来源: 题型:
【题目】铜与浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 混合气体,这些气体与3.36LO2(标况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸,则消耗铜的质量为( )
A.6.4g B.9.6g C.19.2g D.无法计算
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下的密闭容器中存在如下反应:A(g)+B(g)![]() C(g)+D(g),已知A和B的起始浓度均为3mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
C(g)+D(g),已知A和B的起始浓度均为3mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
(1)达到平衡时,A的转化率为多少?(3分)
(2)当A的起始浓度仍为3mol·L-1,B的起始浓度为6mol·L-1,求:平衡时A的体积分数?(3分)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+![]() O2(g)=H2O(l) ΔH3=-285.8 kJ/mol
O2(g)=H2O(l) ΔH3=-285.8 kJ/mol
则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为
A.-870.3 kJ/mol B.-571.6 kJ/mol
C.+787.0 kJ/mol D.-488.3 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】t℃时,将2 mol气体A和1 mol气体B充入容积为2 L的恒容密闭容器中,发生如下反应:2A(g) + B(g)![]() xC(g),2 min时化学反应达到限度(温度仍为t℃),此时B还有 0. 6 mol,并测得C的浓度为0.6 mol L-1,请回答下列问题:
xC(g),2 min时化学反应达到限度(温度仍为t℃),此时B还有 0. 6 mol,并测得C的浓度为0.6 mol L-1,请回答下列问题:
(1)判断该反应达到限度的标志是_______,
a.容器中的压强保持不变
b. A的生成速率与B的消耗速率之比为2∶1
c.容器内混合气体的密度保持不变
d. A的百分含量保持不变
e. B和C的物质的量浓度之比为1∶x
(2)x=_______,从反应开始到达到限度时,用B表示该反应的平均反应速率V(B) =____________;
(3)若保持温度不变,增大容器体积,则正反应速率___________(填“增大”、“减小”或“不变”)
(4)化学反应达到限度时,A的转化率为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,一定浓度的某酸HA溶液的pH=5,下列有关说正确的是
A. 向溶液中加入适量NaA固体,若溶液pH不变,则HA为强酸
B. 若HA为弱酸,则该溶液导电能力比等体积pH=5的盐酸弱得多
C. 若HA为弱酸,则加入等体积pH=9的NaOH溶液,所得溶液pH>7
D. 取该溶液1.00mL,加水稀释至1000mL,所得溶液pH=8
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂的污水中可能含有NH4+、Fe2+、Cl-、Fe3+、SO42-、HCO3-离子中的一种或几种,为检验上述离子,某兴趣小组设计了如下实验方案,请回答下列问题:

下列说法正确的是
A. 该污水中一定存在Fe3+,不存在Fe2+ B. 沉淀l为BaCO3和BaSO4
C. 沉淀2可能为AgCl和Ag2SO4 D. 该污水中一定存在NH4+、Cl-、Fe3+、SO42-离子
查看答案和解析>>
科目: 来源: 题型:
【题目】以对羟基苯甲醛为原料,合成降血脂药物环丙贝特的流程图如下:

已知: 
请回答下列问题:
(1)下列说法不正确的是___________。
A.环丙贝特分子中存在2个手性碳原子 B. D的分子式为C14H16Cl2O3
C.C中含有的官能团有醚键、酯基和碳碳双键 D.反应②③⑤均为取代反应
(2)B的结构简式为____________ 。
(3)写出A与足量溴水反应的化学方程式为____________ 。
(4)请写出符合下列条件的A的所有同分异构体的结构简式____________ 。
i分子中含有苯环,不含其他环状结构
ii 1H-NMR谱显示共有4个峰
(5)已知:①
②苯环上有甲基时,新取代基主要取代在邻位或对位,有醛基时主要取代在间位。请写出以甲苯为原料合成![]() 的流程图,其他无机原料任选。__________________
的流程图,其他无机原料任选。__________________
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】某氮的氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化碳。若测得氮气和二氧化碳的物质的量之比为1∶2,则该氮的氧化物是( )
A.N2O B.NO
C.NO2 D.N2O5
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年9月,“乔歌里1号”中国首台静默移动发电站MFC30正式问世,MFC30是基于甲醇重整制氢燃料电池发电技术。
(1)甲醇制氢方式主要有以下三种:反应Ⅰ甲醇水蒸气重整制氢:CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) △H1=+49.4 kJ/mol反应Ⅱ甲醇分解制氢:CH3OH(g)
CO2(g)+3H2(g) △H1=+49.4 kJ/mol反应Ⅱ甲醇分解制氢:CH3OH(g)![]() CO(g)+2H2(g) △H2=+90.6 kJ/mol反应Ⅲ气态甲醇氧化重整制氢同时生成二氧化碳和氢气:
CO(g)+2H2(g) △H2=+90.6 kJ/mol反应Ⅲ气态甲醇氧化重整制氢同时生成二氧化碳和氢气:
①已知CO的燃烧热为283.0 kJ/mol,则反应Ⅲ的热化学反应方程式为____________。
②该三种制氢方式中,等量的甲醇产生氢气最多的是反应____________。(填“Ⅰ”、“Ⅱ”、“Ⅲ”)
(2)实验室模拟反应Ⅰ甲醇水蒸气重整制制氢观察,合成气组成n(CH3OH): n(H2O)=1∶1时,体系中甲醇的平衡转化率与温度和压强的关系如图所示。

①该反应的平衡常数表达式为____________________。
②当温度为250℃、压强为P2时,反应达平衡时H2的体积分数为____________。
③图中的压强由小到大的顺序是____________。
(3)MFC30燃料电池是以氢为燃料,Li2CO3与K2CO3混合的碳酸盐为电解质的高温型燃料电池,其负极的电极反应式为____________,正极上通入的气体为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用右图装置,完成很多电化学实验。下列有关此装置的叙述中,不正确的是
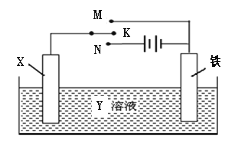
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阳离子向铁电极移动
C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com