
科目: 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持、加热仪器已略去,气密性已检验)。
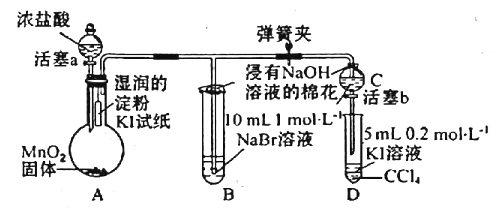
实验过程;
I.打开弹簧夹,打开活塞a,清加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。
Ⅳ……
(1)A中产生的是黄绿色气体,其离子方程式为_________________,在该反应中浓盐酸表现了____性。
(2)验证氯气的氧化性强于碘的实验现象是____________________。
(3)B中溶液发生反应的离子方程式是____________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是____________________。
(5)浸有NaOH溶液的棉花作用是____;离子方程式为____________________。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下____,得电子能力逐渐减弱。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。下列有关评价正确的是

A.根据图Ⅰ所示实验,可以根据澄清石灰水是否变浑浊鉴别碳酸钠和碳酸氢钠固体
B.在图Ⅱ所示实验的左右两只试管中加入足量的盐酸,然后向两个气球中分别加入等物质的量的碳酸钠和碳酸氢钠固体,根据反应后气球的大小可鉴别两种固体
C.与实验Ⅲ相比,实验Ⅳ的突出优点是可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
D.若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则小试管B中装入的固体是碳酸钠
查看答案和解析>>
科目: 来源: 题型:
【题目】痕检是公安机关提取犯罪嫌疑人指纹的一种重要方法,AgNO3显现法就是其中的一种:人的手上有汗渍,用手动过白纸后,指纹就留在纸上。如果将溶液①小心地涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐增多,由棕色变成黑色的指纹线。用下列化学式表示这三种物质都正确的是( )
A.①AgNO3 ②NaBr ③AgBr
B.①AgNO3 ②NaCl ③AgCl
C.①AgCl ②AgNO3 ③NaCl
D.①AgNO3 ②NaI ③AgI
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关钠及其化合物的说法不正确的是
A. 电解饱和食盐水可制取金属钠 B. 钠与氧气反应的产物与反应条件有关
C. 氧化钠与水反应生成氢氧化钠 D. 钠可以从四氯化钛中置换出钛
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
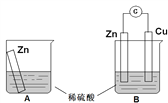
(1)A烧杯中反应的离子方程式为_________。
(2)B中Zn板是_________极,发生的电极反应是_________,Cu板上的现象是_________,发生的电极反应是_________。
(3)从能量转化的角度来看,A、B中反应物的总能量_________(填“大于”、“小于”或“等于”)生成物总能量,A中是将化学能转变为_________,B中主要是将化学能转变为_________。
(4)该小组同学反思原电池的原理,其中观点正确的是_________(填字母序号)。
A.原电池反应的过程中一定有电子转移
B.原电池装置需要2个电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
查看答案和解析>>
科目: 来源: 题型:
【题目】N2O5在一定温度下可发生下列反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。T1温度下的部分实验数据为:
4NO2(g)+O2(g) ΔH>0。T1温度下的部分实验数据为:
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/mol/ L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A. 500 s内N2O5分解速率为2.96×10-3mol/(L·s)
B. T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
查看答案和解析>>
科目: 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol![]() L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
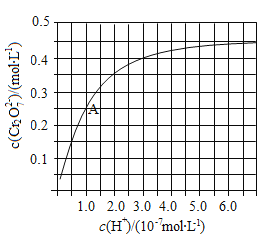
①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH______0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为_______ mol![]() L1,此时溶液中c(CrO42)等于__________ mol
L1,此时溶液中c(CrO42)等于__________ mol![]() L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72还原成Cr3+,该反应的离子方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是
A.化学反应速率的关系是2v逆(NH3)=3v正(H2O)
B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态
C.达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D.达到化学平衡时4v正(O2)=5v逆(NO)
查看答案和解析>>
科目: 来源: 题型:
【题目】腐乳是桂林有名的特产之一,请参考图中的有关信息回答下列问题。

(1)制作腐乳的主要原料是黄豆,黄豆富含人体所需的营养物质主要是_______。制作腐乳用到了加碘盐,即在食盐中加入_______(写出碘化合物的名称或化学式)。
(2)腐乳在酿制过程中会产生多种氨基酸,故味道鲜美,这些氨基酸的通式为________。腐乳虽好但不能作为主食,原因在于腐乳所含的_______类营养素较少,而该类营养素是人类生命活动所需能量的主要来源物质。
(3)盛装腐乳的陶罐属于_______(填“无机”或“有机”)非金属材料制品,陶罐的主要成分为_______酸盐。
(4)外包装纸盒所用纸的主要成分是____________。包装盒提绳的主要成分是聚丙烯塑料,由丙烯合成聚丙烯的化学方程式为:_____________________________。
(5)聚丙烯等材料制成的塑料制品不应随意丢弃,以免造成俗称“_________污染”的环境问题。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com