
科目: 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g) + 3H2(g) ![]() 2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。请回答下列问题:
2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。请回答下列问题:
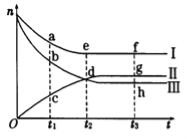
(1)上图中属于氢气物质的量随时间变化的曲线是 (填“I”、“II”或“Ⅲ”)。
(2)关于t2时刻的说法正确的是
A.t2时该反应达到平衡状态
b.t2时II和III代表的物质反应速率相同
c.t2时氢气、氮气与氨气的反应速率之比为3:1:2
D.t2时氨气与氢气的物质的量相同
(3)对于II所代表的物质,其逆反应速率最大的点是__________(填“c”、“d”或“g”);对于I所代表的物质,其正反应速率最小的点是___________ (填“a”、“e”或“f”)。
(4)其他条件不变,只改变温度,在改变的这个温度下反应至t3时刻,此时n(H2)比图象中的值大,那么该温度可能是____________(填序号)
A.673 K B.273 K C.373 K
(5)在密闭容器中充入2 mol N2和6 mol H2,—定条件下建立平衡:N2(g) + 3H2(g) ![]() 2NH3(g) △H=-92.2kJ/mol,测得 N2 的转化率为 90%,则在此条件下,反应放出的热量为___________kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应_________(填“放出”或“吸收”)的热量为___________kJ。
2NH3(g) △H=-92.2kJ/mol,测得 N2 的转化率为 90%,则在此条件下,反应放出的热量为___________kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应_________(填“放出”或“吸收”)的热量为___________kJ。
查看答案和解析>>
科目: 来源: 题型:
【题目】某元素的离子的结构示意图与Mg2+相同,则下列说法正确的是( )
A.该元素一定在第三周期
B.该元素一定在第二周期
C.若该离子是阳离子,则该元素一定在第三周期
D.若该离子是阴离子,则该元素一定在第三周期
查看答案和解析>>
科目: 来源: 题型:
【题目】己知NA是阿伏加徳罗常数,下列说法正确的是( )
A. 7.lg氯气与足量的氢氧化钠溶液反应转移的电子数为0.2NA
B. V L amol/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA
C. 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.0NA
D. 工业用电解法进行粗铜精炼时,毎转移lmol电子,阳极上溶解的铜原子数必为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol、b mol碘化氢(a>b),待反应2HI(g)![]() I2(g) + H2(g)达平衡后,下列说法肯定正确的是()
I2(g) + H2(g)达平衡后,下列说法肯定正确的是()
A. 从反应开始到建立平衡的平均速率:vA<vB
B. 平衡时I2的浓度:c(I2)A=c(I2)B
C. 平衡时碘蒸气在混合气体中的百分含置:A容器大于B容器
D. 平衡时HI的分解率:αA=αB
查看答案和解析>>
科目: 来源: 题型:
【题目】NiSO46H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:
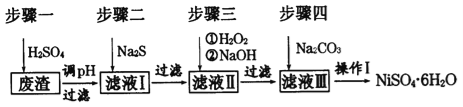
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取速率可采取的措施有_____________(任写一点)。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式:_______________。
(3)上述流程中滤液Ⅲ的主要成分是___________。
(4)确定步骤四中Na2CO3溶液足量,碳酸镍己完全沉淀的简单实验方法是______________。
(5)操作I的实验步骤依次为(实验中可选用的试剂:溶液、蒸馏水、pH试纸):
①_______________;
②_______________;
③蒸发浓缩、冷却结晶,过滤得NiSO4·6H2O晶体
④ 用少量乙醇洗涤NiSO4·6H2O晶体并晾干
查看答案和解析>>
科目: 来源: 题型:
【题目】19世纪中叶,门捷列夫总结了如表所示的元素化学性质的变化情况。请回答:
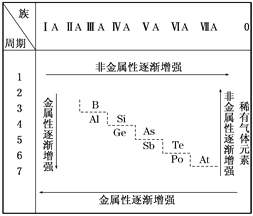
(1)门捷列夫的突出贡献是__________。
A.提出了原子学说
B.提出了分子学说
C.发现了元素周期律
D.发现能量守恒定律
(2)该表变化表明__________。
A.事物的性质总是在不断地发生变化
B.元素周期表中最右上角的氦元素是非金属性最强的元素
C.第ⅠA族元素的金属性肯定比同周期的第ⅡA族元素的金属性强
D.物质发生量变到一定程度必然引起质变
(3)按照表中元素的位置,认真观察从第ⅢA族的硼到第ⅦA族的砹连接的一条折线,我们能从分界线附近找到__________。
A.耐高温材料 B.新型农药材料
C.半导体材料 D.新型催化剂材料
(4)据报道,美国科学家制得一种新原子![]() X,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是__________。
X,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是__________。
A.这种原子的中子数为167 B.它位于元素周期表中第6周期
C.这种元素一定是金属元素 D.这种元素的原子易与氢化合
查看答案和解析>>
科目: 来源: 题型:
【题目】己知有机物A是一种重要的化工原料,其在标准状况下的密度为1.25g/L。
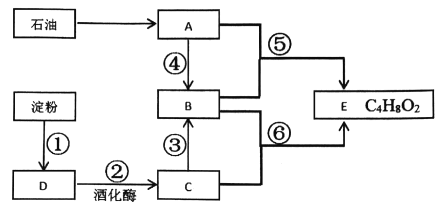
(1)C中的官能团名称________________;⑥的反应类型______________;
(2)反应⑤的反应方程式为______________;
(3)下列说法正确的是_______________。
A.淀粉发生反应①后直接加银氨溶液可以检验D的生成
B.B、C、E可以用饱和碳酸钠溶液鉴别
C.反应⑥中浓硫酸的作用是催化剂和吸水剂
D.①和④的反应类型相同
查看答案和解析>>
科目: 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义。
I.利用下图装置模拟工业生产中SO2催化氧化的反应并研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)

(1)甲同学按I、II、III、IV的顺序连接装置,装置II的作用是_________;装置III中溶液逐渐褪色,证明二氧化硫具有___________性。
(2)乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置(装置Ⅱ中充分冷却),若装置Ⅳ中有40 mL 3.0mol/L NaOH溶液,反应后增重5.12 g,则装置Ⅳ中发生反应的化学方程式是_______________。
(3)某同学将足量的SO2通入一支装有氯化钡溶液的试管中,未见沉淀生成。向该试管中加入足量________(填字母),便能产生沉淀。
A.硫化钠溶液 B.氨水 C.盐酸 D.硝酸钾溶液
Ⅱ.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
称取铁钉(碳素钢)6g放入15mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
(4)甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+应选用________(填序号)。
a.KSCN溶液和氯水 b.氢氧化钠溶液
c.酸性KMnO4溶液 d.铁粉和KSCN溶液
(5)乙同学取784mL(标准状况)气体Y通入足量H2O2水溶液中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积百分数为____________。(保留小数点后一位)
(6)分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和CO2气体,产生CO2的理由是_______________(用化学方程式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,5 mL 0.1 mol /L的 H2SO4和15 ml 0.1 mol/L的NaOH溶液相混合,并稀释至500 ml,最后所得溶液的pH为( )
A.12.3 B.11 C.3 D.1.7
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中一定能说明金属A比金属B的活动性强的是( )。
A.A原子的最外层电子数比B原子的最外层电子数少
B.A原子电子层数比B原子电子层数多
C.1 mol A从酸中置换出的H2比1 mol B从酸中置换出的H2多
D.常温时,A能从稀盐酸中置换出氢,而B不能和稀盐酸发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com