
科目: 来源: 题型:
【题目】“纳米材料”是粒子直径为几纳米至几十纳米的材料,纳米碳就是其中一种.若将纳米碳均匀地分散到蒸馏水中,对形成的物质的描述正确的是( ) ①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过半透膜 ⑤不能透过半透膜
⑥能透过滤纸 ⑦不能透过滤纸 ⑧静置后会析出黑色沉淀.
A.①⑤⑦⑧
B.②③④⑦
C.②③⑤⑥
D.①④⑥⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如下表:
化学式 | CH3COOH | H2CO3 | HClO | |
平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1) 物质的量浓度均为0.1mol·L一1的四种溶液:a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3,pH由小到大的排列顺序是___________ (用字母表示)
(2) 常温下,0.1mol·L—1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_______ (填序号)
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH—) D.c(OH-)/c(H+)
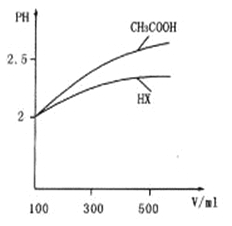
(3) 体积均为l00mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_______ (填“>”、“<”或“=”)CH3COOH的电离平衡常数。
(4) 25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中:
① c(CH3COO—)—c(Na+)=_______ mol·L—1(填精确值)
② c(CH3COO-)/c(CH3COOH)=_______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下向10mL0.1mol/L的HR溶液中逐渐滴入0.1mol/L的NH3·H2O溶液, 所得溶液pH及导电性变化如图。下列分析不正确的是

A.a~b点导电能力增强,说明HR为弱酸
B.b点溶液pH=7,说明NH4R没有水解
C.c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
D.b~c任意点溶液均有c(H+)×c(OH-)=Kw=1.0×10-14
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO: MgSO4(s)+CO(g) ![]() MgO(s)+CO2(g)+SO2(g) △H >0,该反应在某密闭容器中达到平衡。下列分析正确的是
MgO(s)+CO2(g)+SO2(g) △H >0,该反应在某密闭容器中达到平衡。下列分析正确的是
A. 恒温恒容时,充入CO气体,达到新平衡时![]() 增大
增大
B. 容积不变时,升高温度,混合气体的平均相对分子质量减小
C. 恒温恒容时,分离出部分SO2气体可提高MgSO4的转化率
D. 恒温时,增大压强平衡逆向移动,平衡常数减小
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素R、X、Y、Z的原子序数依次增大, a、b、c、d是这4种元素的单质(a、b、c、d顺序不与R、X、Y、Z对应),a为生活中常见的金属,厨房中常见a金属合金餐具和器具。在甲的溶液中通入丙气体,产生白色沉淀,它们之间转化关系如图所示。
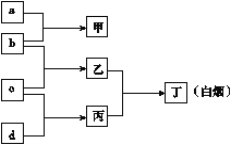
回答下列问题:
(1)写出Z元素在元素周期表中的位置______________________;
(2)写出物质丙的电子式__________________;
(3)X、Y、Z元素简单离子的半径由大到小排列的顺序为(用离子符号表示)______________;
(4)写出Y元素的氢氧化物与NaOH溶液反应的离子方程式______________________________;
(5)As(砷)与X是同族元素,位于第四周期,请写出砷原子的原子结构示意图____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】液氨和水类似,也能电离:NH3+NH3![]() NH4++ NH2-,25℃时,其离子积K=l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是(设温度保持不变,溶液体积为1L)( )
NH4++ NH2-,25℃时,其离子积K=l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是(设温度保持不变,溶液体积为1L)( )
A.c(Na+) = c(NH2-) B.c (NH4+) = 1×10-29mol/L
C.c(NH2-) > c (NH4+) D.c(NH4+)c(NH2-) = l.0×l0-30
查看答案和解析>>
科目: 来源: 题型:
【题目】电解原理在工业中有广泛应用。如图是一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
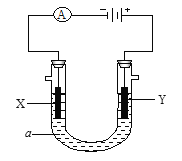
请回答以下问题:
(1) 若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式是: 。
在X极附近观察到的现象是: 。
②Y电极上的电极反应式是: ,
检验该电极反应产物的方法是: 。
(2) 如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是: ,电极反应式是: 。
②Y电极的材料是: ,电极反应式是: 。
(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目: 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其分子式是________。
(2)验证氯气的氧化性强于碘的实验现象是_________________________________________;
(3)B中溶液发生反应的离子方程式是_____________________________________________;
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是__________________________________________________________________________________________________________;
(5)过程Ⅲ实验的目的是________________________________________________________;
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下__________________,得电子能力逐渐减弱。
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)![]() 2Z(g);ΔH<0。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是
2Z(g);ΔH<0。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是
选择 | 改变的条件 | 正、逆反应速率变化 | 新平衡和原平衡比较 |
A | 升高温度 | 逆反应速率增大量大于正反应速率增大量 | Z的体积分数变大 |
B | 增大压强 | 正反应速率增大,逆反应速率减小 | Z的浓度不变 |
C | 减小压强 | 正、逆反应速率都减小 | Y的体积分数变大 |
D | 充入少量Z | 逆反应速率增大 | X的体积分数不变 |
查看答案和解析>>
科目: 来源: 题型:
【题目】为合理利用“垃圾”资源,提倡垃圾分类回收,生活中废弃的铁锅、铝制易拉罐等可以归为一类加以回收,它们属于
A. 有机物 B. 无机盐 C. 金属或合金 D. 难溶性碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com