
科目: 来源: 题型:
【题目】下列浓度关系正确的是
A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) >c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在实验报告中记录了下列数据,其中正确的是( )
A. 用25 mL量筒量取12.36 mL盐酸
B. 用pH试纸测出某溶液pH为3.5
C. 用托盘天平称取8.75 g食盐
D. 用酸式滴定管测出消耗盐酸的体积为15.60 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】市场上销售的香肠、盐水鸭、榨菜、豆腐干等食品,常采用真空包装,真空包装的目的是除去空气,使大多数微生物因缺少_________而受到抑制,停止繁殖,同时防止食品发生__________而变质。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图。某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中不正确的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论)

选项 | 预测物质的化学式 | 预测所需指示剂 | 操作、现象及结论 |
A | Na2SO4 | 稀盐酸、氯化钡溶液 | 取少量该溶液于试管中,滴入稀盐酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液是Na2SO4溶液 |
B | Na2CO3 | 稀盐酸、澄清石灰水 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清石灰水变浑浊,则原溶液是Na2CO3溶液 |
C | Na2SO3 | 稀盐酸、澄清石灰水、品红溶液 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清石灰水变浑浊,还能使品红溶液褪色,则原溶液是Na2SO3溶液 |
D | Na2SiO3 | 过量稀盐酸 | 取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,则原溶液是Na2SiO3溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下图装置,能完成很多电化学实验。下列有关此装置的叙述中,错误的是( )

A. 若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
B. 若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,这种方法称为外加电流的阴极保护法
C. 若X为铜棒,Y为硫酸铜溶液,开关K置于M处时,铁电极上的电极反应式为:Cu2++2e-===Cu
D. 若X为铜棒,Y为硫酸铜溶液,开关K置于N处时溶液中各离子浓度都不会发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是元素周期表的一部分,下列说法中正确的是
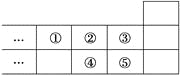
A. 元素①位于第2周期第ⅣA族
B. 气态氢化物的稳定性:④>②
C. 最高价氧化物对应水化物的酸性:⑤>④
D. 元素的最高正化合价:③=⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的热点。
(1) NaBH4是一神重要的储氢载体,能与水反应生成NaBO2,且反应前后B的化合价不变,该反应的化学方程式为_________,反应消耗1molNaBH4时转移的电子数目为___________。
(2) H2S热分解可制氢气。反应方程式:2H2S(g)=2H2(g)+S2(g) △H;在恒容密闭容器中,测得H2S分解的转化率(H2S起始浓度均为c mol/L)如图1所示。图l中曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。

①△H ______0(填“>”“<”或“=”);
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则t min内反应速率v(H2)=_____(用含c、t的代数式表示);
③请说明随温度升高,曲线b向曲线a接近的原因____________。
(3) 使用石油裂解的副产物CH4可制取H2,某温度下,向体积为2L的密闭容器中充入0.40mol CH4(g)和0.60molH2O(g)的浓度随时间的变化如下表所示:

①写出此反应的化学方程式_________,此温度下该反应的平衡常数是_________。
②3 min时改变的反应条件是_________(只填一种条件的改变)。
③一定条件下CH4的平衡转化率与温度、压强的关系如图2所示。则P1_________P2填“>”、“<”或“=“)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A===H++HA-,HA-![]() H++A2-回答下列问题:
H++A2-回答下列问题:
(1)Na2A溶液显________(填“酸性”“中性”或“碱性”),用离子方程式表示其原因________________。
(2)在0.1 mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是____________。
A.c(A2-)+c(HA-)+c(H2A)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HA-)+2c(H2A)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
(3)常温下,已知0.1 mol·L-1NaHA溶液的pH=2,则0.1 mol·L-1H2A溶液中c(H+)可能___________(填“>”、“<”或“=”)0.11 mol·L-1;理由是_______________________。
(4)比较①0.1 mol·L-1 Na2A溶液 ②0.1 mol·L-1 Na2SO4溶液,两种溶液中阴离子总浓度的大小①________②(填“>”、“<”或“=”)。
(5)O3可由臭氧发生器(原理如图)电解稀硫酸制得。

①图中阴极为______________(填“A”或“B”),其电极反应式为_______________________。
②若C处通入O2,则A极的电极反应式为______________。
③若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为______________(忽略O3的分解)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿( PbS)直接制备硫酸铅粉末的流程如下:
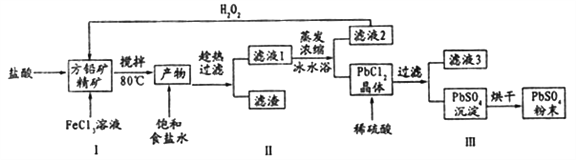
已知:(i) PbCl2 (s)+2C1-(aq)=PbCl42-(aq) △H>0
(ii)有关物质的Ksp和沉淀时的pH如下:
物质 | Ksp | 物质 | 开始沉淀时pH | 完全沉淀时pH |
PbSO4 | 1.0×10-8 | Fe(OH)3 | 2.7 | 3.7 |
PbCl2 | 1.6×10-5 | Pb(OH)2 | 6 | 7.04 |
(1)步骤I反应加入盐酸后可以观察到淡黄色沉淀生成,请写出的离子方程式___________。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因____________。
(3)在上述生产过程中可以循环利用的物质有______________。
(4)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式________________。
(5)铅的冶炼、加工会使水体中重金属铅的含量增大造成严重污染。某课题组制备了一种新型脱铅剂(用EH表示),能有效去除水中的痕量铅,脱铅过程中主要发生的反应为:2EH(s)+Pb2+![]() E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
A.4~5 B.6~7 C.9~10 D.11~12
(6)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KC1混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。

①放电过程中,Li+向_______移动(填“负极”或“正极”)。
②负极反应式为_____________。
③电路中每转移0.2mol电子,理论上生成_________g Pb。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com