
科目: 来源: 题型:
【题目】工业上用软锰矿(主要成分MnO2,杂质金属元素Fe、Al等) 制备MnSO4·H2O 的一种工艺流程如下:

已知:
1.浸出过程中发生的主要反应化学方程式为:MnO2+SO2 =MnSO4
2.浸出液中阳离子主要有Mn2+、Fe2+、Al3+等
回答下列问题:
(1)物质X最好选用
a.盐酸 b.硫酸 c.硝酸
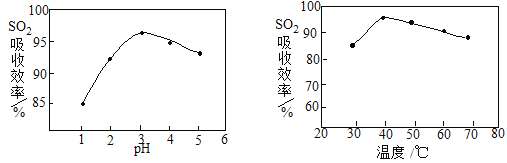
(2)酸浸时SO2的吸收效率与pH、温度的关系如下图所示,为提高SO2的吸收效率,酸浸适宜的条件是 。
(3) 流程中“氧化”步骤主要反应的离子方程式是 。
(4) 加入石灰浆调节pH,可将氧化后的浸出液中Fe3+、Al3+形成氢氧化物除去。检验Fe3+是否除尽的最佳方法是 。
(5) 用MnSO4可测定水中溶解氧,方法是:取100 mL 水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用5.00×10-3 mol·L-1 Na2S2O3溶液和I2反应,当消耗Na2S2O3溶液 12.0 mL时反应完全。有关化学反应方程式如下:
① 2Mn2++O2+4OH-=2MnO(OH)2(反应很快);
② MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
③ I2+2S2O32-=S4O62-+2I-。
计算水样中溶解氧的浓度(以mg·L-1为单位),写出计算过程。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,向H2C2O4溶液中逐滴加入NaOH溶液,所得溶液中H2C2O4,HC2O4-,C2O42-三者物质的量分数(分布系数)随pH变化的关系入左图所示。右图为不同浓度NaHC2O4溶液中部分微粒浓度。下列表述错误的是
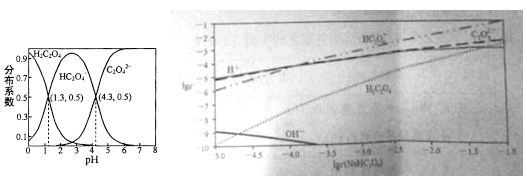
A. HC2O4-![]() H++C2O42- K=1×10-4.3
H++C2O42- K=1×10-4.3
B. 将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得溶液pH恰好为4.3
C. NaHC2O4溶液中一定存在c(C2O42-)>c(H2C2O4),同时c(H+)>c(OH-)
D. 在0.1mol/L NaHC2O4溶液中各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)> c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酸是醋的主要成分,而醋几乎贯穿了整个人类文明史,其中有文献记载的酿醋历史至少也在三千年以上。
(1)写出乙酸在水溶液中的电离方程式_____________
(2)25℃下,CH3COOH在水中电离的ΔH为+8.8kJ/mol,电离常数Ka为2×10-5,又知HCl(aq)与NaOH(aq)反应的ΔH为-57.3kJ/mol,则CH3COONa水解时的ΔH为_____,水解平衡常数为Kh为_______。
近年来,研究者利用乙酸开发出新工艺合成乙酸乙酯,使产品成本明显降低,其主要反应为:
CH2=CH2(g)+CH3COOH(l) ![]() CH3COOC2H5(l)
CH3COOC2H5(l)
(3)该反应属于有机反应类型中的_____________。
(4)下列描述能说明乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是____________。
A.乙烯、乙酸、乙酸乙酯的浓度相同
B.酯化合成反应的速率与酯分解反应的速率相等
C.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol
D.体系中乙烯的百分含量一定
下图为n(乙烯)与n(乙酸)物料比为1时,在不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。回答下列问题:
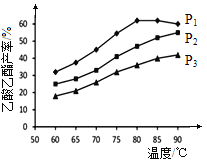
(5)温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是________[用![]() (P1)、
(P1)、![]() (P2)、
(P2)、![]() (P3)分别表示不同压强下的反应速率],分析其原因为____________。
(P3)分别表示不同压强下的反应速率],分析其原因为____________。
(6)压强为P1MPa、温度60℃时,若乙酸乙酯的产率为30℅,则此时乙烯的转化率为_______。
(7)压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用湿法炼锌产生的铜镉渣生产金属镉的流程如下:

已知:铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 | 10.6 |
(1)为了提高铜镉渣浸出的速率,可采取的措施有:①适当升高温度;②搅拌;③______等。已知浸出的金属离子均为二价,写出浸出钴的化学方程式__________________。
(2)除钴的过程中,需要加入活化剂Sb2O3,锌粉会与Sb2O3、Co2+的溶液形成微电池并产生合金CoSb。该微电池的正极反应式为________________________________。
(3)除铁的过程分两步进行:
①先加入适量KMnO4,发生反应的离子方程式为______________________________,
②再加入ZnO控制反应液的pH范围为_____________。
(4)除铁过程第①步,若加入KMnO4时条件控制不当,MnO2会继续反应,造成的结果是______________,若加入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证_________________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是____。
(6)处理含镉废水常用化学沉淀法,以下是几种镉的难溶化合物的溶度积常数(25℃):
Ksp(CdCO3)=5.210-12, Ksp(CdS)=3.610-29,Ksp(Cd(OH)2)=2.010-16,根据上述信息:
沉淀Cd2+效果最佳的试剂是____________。
a.Na2CO3 b.Na2S c.CaO
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H2(g)、CO(g)、CH3OH(l)的燃烧热![]() H分别是-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。下列有关叙述正确的是( )
H分别是-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。下列有关叙述正确的是( )
A.甲醇不完全燃烧生成CO和液态水的热化学方程式:
CH3OH(l)+O2 (g)== CO(g)+2H2O(l) △H1=-1009.5kJ·mol-1
B.CH3OH(l)+1/2O2 (g)== CO2(g)+2H2 (g) △H1=-440.7kJ·mol-1
C.2H2O(g) == 2H2(g)+O2(g) △H1 =+571.6 kJ·mol-1
D.已知:S(s)+O2(g) = SO2(g) △H1 ;S(g)+O2(g) = SO2(g) △H2 ;则△H1>△H2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是 ( )
A.该反应的平衡常数表达式为K=[c(CH3OCH3)×c(H2O)]/c(CH3OH)
B.此时正、逆反应速率的大小:v正<v逆
C.若经10 min后反应达到平衡,此时c(CH3OH)=0.04 mol·L-1
D.0~10min内平均反应速率v(CH3OH)=1.6 mol·(L·min)-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 某有机物燃烧只生成CO2和H2O,且二者的物质的量相等,则此有机物的组成为CnH2n
B. 相同质量的烃,完全燃烧,烃中碳的百分含量越高,消耗O2越少
C. 某气态 CxH4若与足量O2完全反应,则反应前后气体体积不变
D .烃在足量的氧气中燃烧并通过浓H2SO4,减少的体积就是生成的水蒸气的体积
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应属于消去反应的是
A. 乙醇与浓硫酸共热到140℃ B. 乙醇与氢溴酸(HBr)反应
C. 乙醇与氧气反应生成乙醛 D. 乙醇与浓硫酸共热至170℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com