
科目: 来源: 题型:
【题目】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液的pH=________。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的主要离子方程式为_______________________________________,由水电离出的
c(OH-)=________mol·L-1。
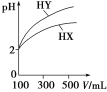
(3)体积均为100 mL、pH均为2的一元酸HX、HY,加水稀释过程中pH与溶液体积的关系如图所示,则HX是________(填“强酸”或“弱酸”),理由是_________________________。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,溶液的pH由大到小的顺序为______________________(填化学式)。
②25 ℃时,在0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的________倍。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因是(用离子方程式表示)__________________ ________。
(2)混合溶液中由水电离出的c(OH-)______0.1 mol·L-1 NaOH溶液中由水电离出的c(OH-)(填“>”、“<”或“=”)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)=________________mol·L-1,
c(OH-)-c(HA)=________________mol·L-1。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH______7(填“>”、“<”或“=”);同温度下等浓度的下列四种盐溶液,按pH由大到小的顺序排列是__________________(填序号)。
A.NH4HCO3 B.NH4A
C.(NH4)2SO4 D.NH4Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】碘是重要的无机化工原料,海藻灰化法是我国目前制碘的主要方法。某研究性学习小组查阅文献,设计并进行了以下模拟实验。
(已知:氯水中含有CL2分子,Cl2 +2I- = 2Cl- + I2)
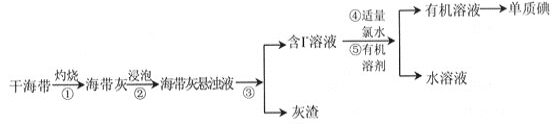
请回答:
(1)步骤①中灼烧海带用到的实验仪器是_____________(填序号)。
a. 试管 b. 坩埚 c. 烧杯 d.蒸发皿
(2)步骤③的实验操作是_______________________。
(3)步骤⑤实验操作可分解为如下几步:
(A)检验分液漏斗活塞和上口的玻璃塞是否漏水
(B)把50毫升碘水和15毫升CCl4加入分液漏斗中,并盖好玻璃塞
(C)倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把漏斗放正
(D)把盛有溶液的分液漏斗放在铁架台的铁圈中
(E)静置,分层
(F)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔
(G)旋开活塞,用烧杯接收溶液
(H)从分液漏斗上口倒出上层水溶液
①上述(G)步骤的操作目的是____________________________________。
②能选用CCl4从碘水中萃取碘的原因是___________________________。
③以下物质中,能用来代替CCl4的是_______。
A汽油 B 酒精 C NaCl溶液 D NaOH溶液
(4)同学们观察到完成步骤⑤后,所得到的水溶液呈淡黄色。某同学推断其中可能含有碘单质,检验方法是: _______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如下流程中a、b、c、d、e、f是六种有机物,其中a是烃类,其余是烃的衍生物。下列有关说法正确的是
![]()
A. 若a的相对分子质量是42,则d是乙醛
B. 若d的相对分子质量是44,则a是乙炔
C. 若a为苯乙烯(C6H5-CH=CH2),则f的分子式是C16H32O2
D. 若a为单烯烃,则d与f的最简式可能相同
查看答案和解析>>
科目: 来源: 题型:
【题目】膳食纤维具有突出的保健功能,称为人体的“第七营养素”。木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示。下列有关芥子醇的说法正确的是
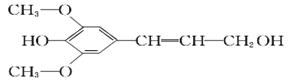
A. 芥子醇的分子式中有一种含氧官能团
B. 芥子醇分子中所有碳原子不可能在同一平面上
C. 芥子醇能与FeCl3溶液发生显色反应,且1mol芥子醇能够与3 mol的Br2水反应
D. 芥子醇能发生的反应类型有氧化、取代、加成
查看答案和解析>>
科目: 来源: 题型:
【题目】下列元素相关粒子的电子排布式中,前者一定是金属元素,后者一定是非金属元素的是( )
A. [Ne]3s1 [Ne]3s2 B. [Ar]4s1 [Ne]3s23p4
C. [Ne]3s2 [Ar]4s2 D. [He]2s22p4 [Ne]3s23p5
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列判断正确的是
A. 8 g O2含有 4NA个电子
B. 1 L 1 mol·L-1的H2SO4溶液所含氧原子数为 4NA
C. 标准状况下,22.4 L O2和CO2的混合气体所含原子数为 2.5 NA
D. 标准状况下,22.4 L CCl4含有NA个分子
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家在一100 ℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键)。下列说法正确的是
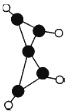
A. X既能使溴的四氯化碳溶液褪色,又能使酸性KMnO4溶液褪色
B. X是一种常温下能稳定存在的液态烃
C. X和l,3-丁二烯类似,能与Br2发生l,2-加成和1,4-加成
D. 充分燃烧等质量的X和甲烷,X消耗氧气较多
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.现有①0.2 mol·L-1NaOH溶液和②0.2 mol·L-1HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X-)。则:
(1)①中由水电离出的c(OH-)__________②中由水电离出的c(H+)(填“>”、“=”或“<”)。
(2)上述混合液中共存在__________种粒子。其中:c(HX)+c(X-)__________0.1 mol·L-1(忽略混合前后溶液体积变化;填“>”、“=”或“<”)。请根据电荷守恒写出一个用离子浓度表示的等式:_____________________________________。
(3)上述混合液显__________性(填“酸”、“碱”或“中”),其原因用离子方程式表示为_______________________________________。
Ⅱ.海水中含有大量的元素,常量元素(如氯)、微量元素(如碘)在海水中均以化合态存在。在25 ℃时,向0.1 mol·L-1的NaCl溶液中逐滴加入适量的0.1 mol·L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1 mol·L-1的NaI溶液,看到的现象是___________________________,产生该现象的原因是(用离子方程式表示)__________________。
[已知25 ℃时Ksp(AgCl)=1.0×10-10、Ksp(AgI)=1.5×10-16]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com