
科目: 来源: 题型:
【题目】(1)有①![]() 、
、![]() 、
、![]() ②H2、D2、T2 ③石墨、金刚石 ④
②H2、D2、T2 ③石墨、金刚石 ④![]() 、
、![]() 、
、![]() 四组微粒或物质。互为同位素的是__________________(填编号)。
四组微粒或物质。互为同位素的是__________________(填编号)。
(2)下列物质中:①N2 ②MgCl2 ③NH4Cl ④CH4 ⑤CO2 ⑥Ne ⑦H2S ⑧KOH ⑨Na2O2 ⑩K2O 只存在共价键的是___________;属于离子化合物,但含有共价键的是______。
(3) 用电子式表示下列物质:
MgCl2___________N2___________NH4+___________Na2O2___________
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,组成一个原电池.
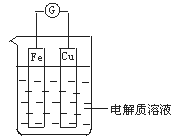
当电解质溶液为硝酸银溶液时:
①Fe电极是__________(填“正”或“负”)极,其电极反应为________________________,该反应是__________(填“氧化”或“还原”)反应;
②Cu电极是__________电极,其电极反应为______________________,该反应是__________反应(填“氧化”或“还原”).
查看答案和解析>>
科目: 来源: 题型:
【题目】将乙醇滴入热的浓硫酸中,发生反应:C2H5OH +6H2SO4 = 6SO2↑+2CO2↑+9H2O,浓硫酸没有体现的性质是
A. 氧化性 B. 脱水性 C. 酸性 D. 吸水性
查看答案和解析>>
科目: 来源: 题型:
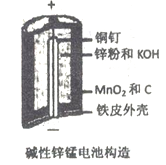
【题目】碱性锌锰电池是日常生活中消耗量最大的电池, 其构造如图所示。放电时总反应为:Zn + 2H2O + 2MnO2==Zn(OH)2 + 2MnOOH 从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下:
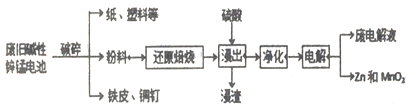
回答下列问题:
(1)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),碳作为还原剂生成CO2,则CO2的电子式为___________。
(2)“净化”是为了除去浸出液中的Fe2+,方法是:加入______(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀。己知浸出液中Mn2+、Zn2+的浓度约为0.1mol·L-1,根据下列数据计算,调节pH的合理范围是____至_______。
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
(离子浓度小于1×10-5 mol·L-1即为沉淀完全)
(3)“电解”时,阳极的电极反应式为______________。
本工艺中应循环利用的物质是____________(填化学式)。
(4)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为___________________。
(5)某碱性锌锰电池维持电流强度0.5A (相当于毎秒通过5×10-6mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有________%的金属锌未参加反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化钡有剧毒,致死量为0.3g,万一不慎误服,应大量吞服鸡蛋清及适量解毒剂,此解毒剂是
A .AgNO3 B .CuSO4 C .MgSO4 D .Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:① A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平 ② ![]() 。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
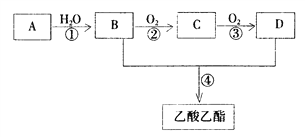
回答下列问题:
(1)B、D分子中的官能团名称分别是_______、_________。
(2)写出下列反应的反应类型:①________,②__________,④_________。
(3)写出下列反应的化学方程式:
①____________________________________________;
②____________________________________________;
④___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气在工业合成中广范应用。
(1)通过下列反应可以制备甲醇:
CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.8kJ/mol,
CH3OH(g) ΔH=-90.8kJ/mol,
CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41.3kJ/mol
CO(g)+H2O(g) ΔH=+41.3kJ/mol
请写出由CO2和H2制取甲醇的热化学方程式______________。
(2)己知合成氨的反应为:N2+3H2![]() 2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和怛容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请冋答下列问题:
2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和怛容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请冋答下列问题:

①图中代表反应在恒容绝热容器中进行的曲线是________(用a、b、c表示)。
②曲线a条件下该反应的平衡常数K=_____________。
③b容器中M点,v(正)________v(逆)(填“大于”、“小于”或“等于”)。
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为________;标准状况下,当阴极收集到11.2LN2时,理论上消耗NH3的体积为_____________。
(4)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中c(NH4+)____ c(HCO3-) (填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3H2O+H2CO3的平衡常数K=_______。
NH3H2O+H2CO3的平衡常数K=_______。
(已知常温下NH3H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7, K2=4×10-11)
查看答案和解析>>
科目: 来源: 题型:
【题目】用下图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
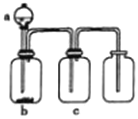
气体 | a | b | c | |
A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
B | SO2 | 浓硫胶 | Cu | 酸性KMnO4溶液 |
C | CO2 | 稀盐酸 | CaCO3 | 浓硫酸 |
D | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】己知A、B、C、D、E、F、G都是周期表中前四周期的元素,他们的原子序数依次增大。其中A原子的L层有2个未成对电子。D是电负性最大的元素,E与F同主族,E的二价阳离子与C的阴离子具有相同的电子层结构。G3+离子3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
⑴A、B、C的第一电离能由小到大的順序为_____________。D的核外有____种运动状态不同的电子。
⑵A的最简单氢化物属于______(填“极性分子”和“非极性分子”)。AH3+离子空间构型是________,其中心原子采取______杂化。
⑶G和M (质子数为25)两元素的部分电离能数据列于下表:
元素 | M | G | |
电离能 (kJmol-1) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态G2+再失去一个电子难。其原因是____________;
⑷晶体熔点:EC____FC (填“ > ”、“<”或“=”),原因是_______________。
(5)H2S和C元素的一种氢化物(分子式为H2C2)的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
h2s | 187 | 202 | 2.6 |
H2C2 | 272 | 423 | 以任意比互溶 |
h2s和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因___________。
(6)FD2晶胞如图,已知DF核间距为a pm,则该晶体密度ρ=______g㎝-3(用带a、NA的算式表示,不必化简)
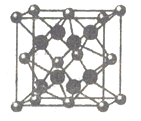
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com