
科目: 来源: 题型:
【题目】化学与生产、生活息息相关,下列叙述错误的是( )
A. 次氯酸钠溶液可用于环境的消毒杀菌
B. 二氧化硫不可广泛用于食品的增白
C. 大量燃烧化石燃料是造成雾霾天气的一种重要因素
D. 光化学烟雾是由SO2引起的环境污染
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、R是周期表前四周期的五种元素,原子序数依次增大。X原子p轨道上有两个未成对电子;Y的气态氢化物能使石蕊试液变蓝色;Z的最外层电子数为其内层电子数的3倍;W的价电子排布式为ns(n-1)np2(n-1);R的最外层只有1个电子,次外层有18个电子。
(1)X、Y、Z、W四种元素中电负性最大的是__________(填元素符号),基态R原子的核外电子排布式为______________。
(2)X、Y、Z的最简单氢化物中,键角由大到小的顺序为_______________(用氢化物的化学式表示)。
(3)Z、W元素构成的微粒WZ42-的立体构型是________,与WZ42-互为等电子体的一种分子为____(填化学式,任写一种)。
(4)每个XY-离子中含有________个π键。
(5)已知Z、R能形成一种化合物R2Z,其晶胞结构如图所示。

①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(![]() ,
, ![]() ,
, ![]() )。则D原子的坐标参数为________,它代表_______(填元素符号)原子。
)。则D原子的坐标参数为________,它代表_______(填元素符号)原子。
②若R2Z晶体密度dg·cm-3,晶胞参数为apm,则阿伏伽德罗常数值NA=______。
查看答案和解析>>
科目: 来源: 题型:
【题目】《化学与生活》模块试题
(1)我国农业因遭受酸雨而造成的损失每年高达15亿多元,酸雨是指pH小于________的雨水,这主要是由人为排放的_______和________(填元素名称)的氧化物等酸性气体转化而成的。为治理酸雨的影响,可将CaCO3粉末撒到受酸雨影响的湖泊中,若用离子方程式表示该反应的本质,请完成如下离子反应:CaCO3+2H+==_____________________________。
主食 | 米饭 |
副食 | 红烧鱼 |
饮品 | 豆浆 |
配菜 | ? |
(2)“民以食为天”,人类生命活动所需的各种营养物质主要来自食物。上表制定的食谱中,主食含有的基本营养物质主要是__________,副食含有的基本营养物质主要是_____________;豆浆所属的分散系为__________________。考虑营养成分的均衡搭配,应补充的配菜是__________________。
(3)水是一种宝贵的自然资源。
①生活污水中,经常包括含__________、___________(填元素符号)的化合物,会造成水体植物营养物质污染。水中的氨在微生物的作用下,可被氧化成HNO2,进而氧化成HNO3,写出这一过程的化学方程式____________________________。
②氧化还原法是处理污水常用的方法。某地工厂排放的污水,经检测,污水中含有0.012 mol/L的游离溴,可用Na2SO3还原除去污水中的溴,请写出其化学方程式:___________________________;处理5 L这种污水,至少需加入0.05 mol/L的 Na2SO3 溶液________L才能将溴全部除去。
查看答案和解析>>
科目: 来源: 题型:
【题目】《化学反应原理》模块试题
(1)已知:N2(g)+3H2(g)![]() 2NH3(g) △H<0。某温度下,将一定量的N2和H2的混合气体充入1L的密闭容器中,充分反应后达到平衡。请回答:
2NH3(g) △H<0。某温度下,将一定量的N2和H2的混合气体充入1L的密闭容器中,充分反应后达到平衡。请回答:
①若N2、H2的反应速率分别用v(N2)、v(H2)表示,则v(N2) ∶v(H2)=_______________。
②若保持其他条件不变,升高温度,平衡________________(填“向正反应方向移动”、“向逆反应方向移动”或“不移动”),化学平衡常数________________(填“增大”、“减小”或“不变”)
(2)根据水溶液中离子平衡的相关知识,回答下列问题:
①铝盐、铁盐可作净水剂。铁盐作净水剂的原因是_____________(用离子方程式表示)
②常温下,柠檬水的pH为3,则溶液中c(OH-)为_______________。
③向稀醋酸雜中滴加NaOH溶液至中性,此时溶液中c(CH3COO-) _____c(Na+)(填“大于”“小于”或“等于”。)
④常温下,向1 mLAgCl饱和溶液中分别加入等体积的以下三种溶液,析出AgCl固体最多的是___________(填字母)。
A.0.1mol/LNaCl B.0.lmol/LMgCl2 C.0.1.mol/L AlCl3
(3)研究化学能与其他能量的转化对生产和生活活有重要意义。请回答:
①一氧化碳是水煤气的主要成分之—,其燃烧热为283.0kJ/mol,则一氧化碳燃烧的热化学方程式为_____________________________________。
②电解法精炼粗铜时,_____________________作阳极 。
③下图所示装置中盐桥的作用是__________________(填字母)
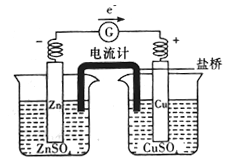
A.使电子通过
B.使两个烧杯中的溶液连成—个通路
C.使ZnSO4溶液和CuSO4溶液均保持电中性
查看答案和解析>>
科目: 来源: 题型:
【题目】下列广告语在科学性上正确的是( )
A. 本产品XX牌八宝粥由莲子、淀粉、桂圆等精制而成,适合糖尿病患者,绝对不含糖
B. 请放心饮用农夫山泉系列饮品,该饮品绝对不含任何化学物质
C. 服用鱼肝油(富含维生素D)有助于您的宝宝骨骼健康,有利于骨骼发育
D. 这种口服液含有丰富的N、P、Zn等微量元素
查看答案和解析>>
科目: 来源: 题型:
【题目】以淀粉为主要原料合成一种具有果香味有机物C和高分子化合物E的合成路线如下图所示。

请回答下列问题:
(1)E的结构简式为_________________, D中含有官能团的名称为:_________。
(2)写出下列反应的反应类型:③____________________,⑤____________________。
(3)写出下列反应的化学方程式:
①____________________________________________________________________ ;
③_____________________________________________________________________。
D与HBr反应:________________________________________________________。
(4)某同学欲用下图装置制备物质C,将试管B中乙酸乙酯分离出来,用到的主要玻璃仪器有:烧杯、____________,试管B中盛装的溶液为_________________,其作用为:__________。

A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
试管A中防止液体加热暴沸所采用的方法是:____________,其中浓硫酸的作用除催化剂外还有:______,目的是:_____________________。(从化学平衡角度分析)
(5)与C互为同分异构且能与Na2CO3反应生成CO2的有机物的结构简式为:_________、___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】丁苯酞(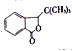 )是国际上首个作用于急性缺血性脑猝中多个病理环节的创新药物,获国家科技进步二等奖。丁苯酞的一种合成路线如下:
)是国际上首个作用于急性缺血性脑猝中多个病理环节的创新药物,获国家科技进步二等奖。丁苯酞的一种合成路线如下:
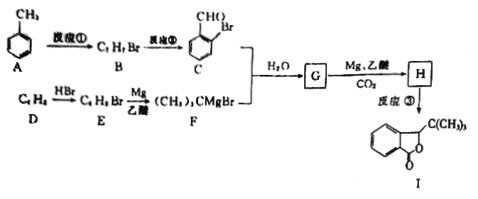
已知: 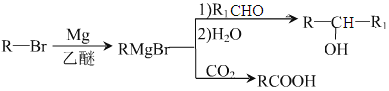
回答下列问题:
(1)H中的含氧官能团的名称是_____________,I的分子式为_______________。
(2)反应①的试剂,条件为_________________,反应②的类型是_________。
(3)G的结构简式为______________________。
(4)由D生成E的化学方程式为____________________。
(5)芳香族化合物M(C8H7OBr)含有和C相同的官能团,其核磁共振氢谱有4组峰,且峰面积之比为2:2:2:1,写出符合条件的所有M的结构简式:_____________________。
(6)参照上述合成路线,以乙醇为原料(其他试剂任选),设计制备CH3CH2COOCH2CH3的合成路线:_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示,
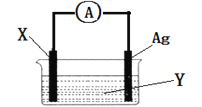
(1)电极X的材料是________________;
电解质溶液Y是_________________;
(2)银电极为电池的______极,发生的电极反应为____________;X电极上发生的电极反应为________________;
(3)外电路中的电子是从____电极流向_____电极。(用电极材料名称作答)
若原来两电极棒质量相等,则当电路中通过0.2mol电子时,两个电极的质量差为__g。
Ⅱ、在一密闭容器中发生反应N2+3H2![]() 2NH3,正反应为放热反应,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
2NH3,正反应为放热反应,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
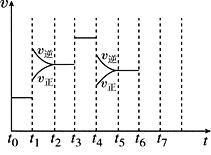
(1)处于平衡状态的时间段是______________(填选项)。
A.t0~t1 B.t1~t2 C.t2~t3
D.t3~t4 E.t4~t5 F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是
t1时刻__________;t3时刻_______;t4时刻_______。
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是_______(填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。_____
(5)合成氨反应起始只投氮气和氢气,一定条件下,反应达到化学平衡状态时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物F是一种香料。其合成路线如图所示:

已知:i. ![]()
ii. 
(1)A的名称为 __________,试剂X的结构简式为__________。
(2)步骤I的反应试剂和条件分别为___________、________________。
(3)步骤II反应的化学方程式为________________________________。
(4)满足下列条件的E的同分异构体有_________种,其中核磁共振氢谱峰面积之比为6 : 2 : 2 : 1 : 1的分子的结构简式为___________________________。
①苯环上只有两个取代基 ②能与FeCl3溶液发生显色反应
③能发生水解反应和银镜反应
(5)依据题中信息,设计以![]() 为原料制取
为原料制取 的合成路线图(无机试剂任选)
的合成路线图(无机试剂任选)
。合成路线图示例如下:___________________________
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:

制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是___________;仪器c的名称是________,反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是_________。下列仪器中可用于分离苯乙酸粗品的是_____________(填标号)。A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是_________,最终得到44 g纯品,则苯乙酸的产率是__________。
(4)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com