
科目: 来源: 题型:
【题目】关于微粒半径大小的下列叙述中不正确的是
A. 同一元素的不同粒子,核外电子数越多,半径越大
B. 同一元素形成的多种价态的离子,价态越低,半径越小
C. 同一元素的原子半径小于相应的阴离子半径
D. 同一元素的原子半径大于相应的阳离子半径
查看答案和解析>>
科目: 来源: 题型:
【题目】已知信息:[Cu(NH3)4]SO4的电离方程式为:[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-。 具有6个配体的Co3+的配合物CoClm·n NH3,若1 mol此配合物与足量的AgNO3溶液反应只生成1 mol AgCl沉淀,则m、n的值分别是
A.m=1,n=5 B.m=3,n=4
C.m=5,n=1 D.m=3,n=3
查看答案和解析>>
科目: 来源: 题型:
【题目】I、煤制天然气的工艺流程简图如下:

⑴反应I:C(s) + H2O(g)![]() CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
⑵反应II:CO(g) + H2O(g) ![]() CO2(g) + H2(g) ΔH = 41 kJ·mol-1。如图表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
CO2(g) + H2(g) ΔH = 41 kJ·mol-1。如图表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。

① 判断T1、T2和T3的大小关系:______________。(从小到大的顺序)
② 若煤气化反应I发生后的汽气比为0.8,经煤气化反应I和水气变换反应II后,得到CO与H2的物质的量之比为1:3,则反应II应选择的温度是_______(填“T1”或“T2”或“T3”)。
⑶① 甲烷化反应IV发生之前需要进行脱酸反应III。煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和_______。
② 工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是_______。
II、利用甲烷超干重整CO2技术可得到富含CO的气体,将甲烷和二氧化碳转化为可利用的化学品,其能源和环境上的双重意义重大。该技术中的化学反应为:
CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g) ![]() H>0
H>0
CH4超干重整CO2的催化转化原理示意如图:

⑷过程II,实现了含氢物种与含碳物种的分离。生成H2O(g)的化学方程式是______________。
⑸假设过程I和过程II中的各步均转化完全,下列说法正确的是_______。((填序号)
a.过程I和过程II中均含有氧化还原反应
b.过程II中使用的催化剂为Fe3O4 和CaCO3
c.若过程I投料![]() ,可导致过程II中催化剂失效
,可导致过程II中催化剂失效
(6)一定条件下,向体积为2L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g) ![]() H>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的
H>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的![]() H=________________。
H=________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A. X与Y形成化合物时,X可以显负价,Y显正价
B. 第一电离能Y一定小于X
C. 最高价含氧酸的酸性X的弱于Y的
D. 气态氢化物的稳定性HbY小于HaX
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为ρg/ml,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是 ( )
A. ρ=(17V+22400)/(22.4+22.4V) B. ω=17c/(1000ρ)
C. ω =17V/(17V+22400) D. c=1000Vρ/(17V+22400)
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为
红棕色。有关的转化关系如下图所示(反应条件均已略去)。
请回答下列问题:

(1)D的化学式为 ;
(2)反应③的离子方程式为 。
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为 。
(4)0.1mol/L的X溶液和0.1mol/L的Y溶液等体积混合,溶液呈________性;(填“酸”、“碱”或“中”)原因是: __________________________________
(用离子方程式说明)
(5)常温下0.1mol/L的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是( )
A.该溶液的pH=11;
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1mol/L的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH值为9;
查看答案和解析>>
科目: 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是一种强氧化剂,在实验室和工业中都有很广泛的应用。同时,由于其具有致癌作用,也是环境污染物之一,必须进行处理。工业上通常以铬铁矿(主要成分为FeOCr2O3,另外还含有SiO2、Al2O3等杂质)为原料制备重铬酸钾,主要流程如下图所示:
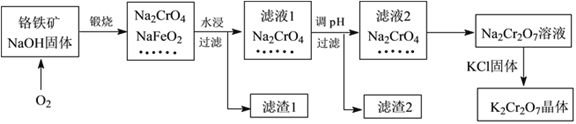
已知:①NaFeO2遇水强烈水解,生成红褐色物质;
②2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
请回答下列问题:
Ⅰ.(1)滤液1的溶质除Na2CrO4、Na2SiO3外,还含有(填化学式)_________________;
(2)由滤液2转化为Na2Cr2O7溶液过程中,能说明反应达平衡状态的是_______(填字母代号);
a.溶液的颜色不变
b.v (CrO42—)= 2v (Cr2O72—)
c.Cr2O72—和CrO42—的浓度相同
(3)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、______________、过滤、洗涤、干燥。
Ⅱ.工业废水中常含有一定量的Cr2O72—和CrO42—,常用还原沉淀法处理。该方法的工艺流程为:
![]()
(4)请写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式___________________;
(5)已知常温下,Cr(OH)3的溶度积Ksp=10-32,要使第步过程中c(Cr3+)降至10-5mol/L,溶液的pH应调至__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。

回答下列问题:
(1)B、D分子中的官能团名称分别是______________、______________。
(2)写出下列反应的反应类型:①__________,②____________,④______________。
(3)写出下列反应的化学方程式:
②_______________________________________________________;
④________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应X(g)+Y(g) ![]() Z(g)+W(s) ΔH>0。下列叙述中,正确的是( )
Z(g)+W(s) ΔH>0。下列叙述中,正确的是( )
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.改变条件,又达新平衡,此时上述反应的平衡常数K值一定增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com