
科目: 来源: 题型:
【题目】工业制硫酸中,SO2的催化氧化是一个可逆反应:2SO2+O2 ![]() 2SO3 ,设该反应在一定条件下,10min达到一定限度,在反应物和生成物之间建立一种动态平衡(即化学平衡),填空:
2SO3 ,设该反应在一定条件下,10min达到一定限度,在反应物和生成物之间建立一种动态平衡(即化学平衡),填空:
SO2 | O2 | SO3 | |
反应开始时的浓度(mol·L-1) | 3.0 | 1.5 | 0 |
10min后的浓度(mol·L-1) | |||
平均反应速率 (mol·L-1·min-1) | 0.1 |
___________、______________、________________、____________、_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】E~N等元素在周期表中的相对位置如下表。E与K的原子序数相差4,K的一种单质是空气中含量最多的物质,H与N属同周期元素,下列判断不正确的是

A.K的氢化物水溶液显碱性
B.F的单质与氧气反应只生成一种氧化物
C.H与N的原子核外电子数相差14
D.最高价氧化物的水化物酸性:K > L > M
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,一反应平衡常数 。恒容时到达平衡后,升高温度,H2浓度减小。下列说法正确的是
。恒容时到达平衡后,升高温度,H2浓度减小。下列说法正确的是
A. 升温,逆反应速率减小 B. 加压,H2浓度减小
C. 增加H2, K减小 D. 该反应的正反应是吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到反应限度的标志是 ( )
2AB(g)达到反应限度的标志是 ( )
A. 容器内的总压强不随时间变化 B. 单位时间内生成2n molAB的同时生成n molB2
C. c(A2):(B2):c(AB)=1:1:2 D. A2和B2的物质的量之和与AB的物质的量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】I、某化学兴趣小组利用以下装置模拟合成氨并制备少量氨水

已知:加热(85℃)NH4Cl和NaNO2饱和溶液可以制取N2
B中仪器名称是___________________;
⑵为了完成实验,装置从左到右接口的连接顺序是_____![]() ______;
______;
⑶D中玻璃纤维的作用是_________________;
⑷小组中甲同学认为F装置不太合理,实验中会产生倒吸。乙同学认真分析后认为该装置无需改进,他的理由是________________________;
II、实验探究
⑸该小组同学利用制备的氨水再进行银镜反应实验。经查阅资料,配制的银氨溶液主要成分是[Ag(NH3)2]OH,小组同学对其组成进行了如下实验探究:
①在洁净的小试管中加入2mL 2%的AgNO3溶液,然后边振荡试管边滴加2%的稀氨水溶液,至最初产生的沉淀恰好溶解为止,制得银氨溶液。
②在制得的银氨溶液中加入无水乙醇,溶液变浑浊,过滤,用__________洗涤,得到白色固体;
③将该白色固体用适量蒸馏水溶解,得到无色溶液,用广范pH试纸检验溶液近似呈中性;向溶液中逐滴加入稀盐酸至不再产生沉淀,静置,取上层清液于另一支放有一小片铜的小试管中并微热,发现铜片的表面有气泡产生,遇到空气变成红棕色;另取少量上层清液加过量的NaOH溶液并加热,得到无色刺激性气体。由此确定通过上述方法制备的白色固体主要成分是___________________;
⑹请根据以上探究,设计实验来制备少量纯净的[Ag(NH3)2]OH溶液:取2mL 2%的AgNO3溶液于洁净的小试管中,_________________,即得到[Ag(NH3)2]OH溶液。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,为测定x值,进行下述实验:①称取Wg草酸晶体配成100.0mL水溶液 ②取25.0mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为amol/L KMnO4溶液滴定。滴定时,所发生的反应为:
2KMnO4 +5H2C2O4 +3H2SO4=K2SO4 +10CO2+2MnSO4 +8H2O 回答下列问题:
(1)实验①中,为配制准确物质的量浓度的草酸溶液,所需用到的仪器是天平(含砝码)、烧杯、药匙、胶头滴管和 _______、 __________ 。
(2)实验②中,滴定时,KMnO4溶液应装在_______式滴定管中(填“酸”或“碱”)
(3)若滴定用的KMnO4溶液因久置而部分变质,浓度偏低,则实验结果所测定的x值将_____(填“偏高”,“偏低”,“无影响”)。
(4)在滴定过程中起指示剂作用的是______,当KMnO4溶液与草酸反应后,怎样判断滴定终点____________________________________________________________________________.
(5)若达到滴定终点时,共用去amol/LKMnO4溶液VmL,则实验测得所配草酸溶液的物质的量浓度为_______;由此计算出草酸晶体中的x值是__________。(结果用a,v, W表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、R、M为元素周期表中前四周期的元素,其原子序数依次增大。X与W、Z与R是分别同族元素;X原子的第一电离能小于同周期前一族元素的原子;Z元素基态原子的核外有3个未成对电子;M元素的单质化学性质稳定,耐腐蚀,其单质及合金是一种优良的航天、航空材料,M的基态原子核外有2个未成对电子。请回答下列问题:
⑴NaZ3可应用于汽车安全气囊,当汽车发生碰撞时,气囊中的NaZ3迅速分解产生大量Z 的单质气体,从而使安全气囊瞬间充气弹出,减轻了乘员受到的伤害。基态Z原子价电子的电子排布图为_____________。与Z3-互为等电子体的分子的化学式为______________(写一个即可),Z3-的空间构型是__________。
⑵W元素可形成[WF6]3-、[WCl4]-配离子,而X只能形成[XF4]-配离子,由此可知决定配合物中配位数多少的因素之一是________________;
⑶已知Y的最高价含氧酸根离子与Na+、K+、NH4+形成的酸式盐溶解度都小于其正盐的溶解度,原因是HCO3-之间以________(填作用力)作用形成长链,减小了HCO3-与水分子之间的作用导致溶解度降低;
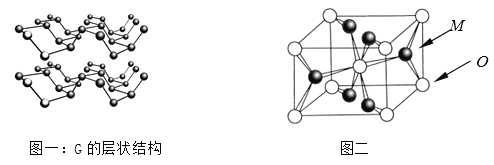
⑷R元素通常有白、红、黑三种颜色的单质,其中最稳定的同素异形体G在通常状态下是一种黑色有金属光泽的晶体,G在储能、电子和光伏发电等领域有着广泛的应用前景,是一种比石墨烯更优秀的新型材料。晶体G具有与石墨类似的层状结构,如图一所示。下列有关G的说法正确的是_______________;
A.G中R原子杂化方式为sp3杂化
B.G中层与层之间的作用力是配位健
C.与石墨类似,G的每一层中R原子都在同一平面上
D.R元素三种常见的单质中,G的熔沸点最高
⑸M与O形成的离子晶体在自然界中存在三种形态,其中金红石型是三种形态中最稳定的一种,其晶胞如图二所示,则M、O配位数之比为________;影响离子晶体结构类型的因素有_____________、____________、键性因素。
查看答案和解析>>
科目: 来源: 题型:
【题目】为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1)若取ag样品,向其中加入足量的NaOH溶液,测得生成气体的体积(标准状况,下同)为b L 。反应的离子方程式为_______________________________________。样品中铝的质量为__________g。
(2)若使ag样品恰好完全反应,则反应中氧化铁与铝的质量比是_________,
化学方程式为___________________________________。
(3)待(2)中生成物冷却后,加入足量盐酸,测得生成的气体体积为c L ,该气体与(1)中所得气体的体积比c:b=____
查看答案和解析>>
科目: 来源: 题型:
【题目】高聚物的合成与结构修饰是制备具有特殊功能材料的重要过程。下图是合成具有特殊功能高分子材料W(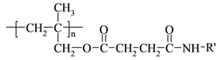 )的流程:
)的流程:
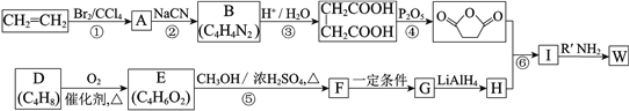
已知:(R、R1、R2代表烃基)
I、![]()
![]() RCH2OH
RCH2OH
II、![]()
⑴反应①的反应类型是_______________。
⑵反应②是取代反应,其化学方程式是___________________________________________。
⑶D的核磁共振氢谱中有两组峰且面积之比是1:3,不存在顺反异构。D的结构简式是______。
⑷反应⑤的化学方程式是__________________________________________________。
⑸G的结构简式是__________________。
⑹反应⑥的化学方程式是__________________________________________________。
⑺工业上也可用![]() 合成E。由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件,
合成E。由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件, 不易发生取代反应)__________________
不易发生取代反应)__________________
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知工业上真空炼铷的反应如下:2RbCl+Mg![]() MgCl2+2Rb(气),对此反应能够进行的正确解释是( )
MgCl2+2Rb(气),对此反应能够进行的正确解释是( )
A. Mg比Rb的金属性强
B. 铷的沸点比镁低把铷的蒸气抽走后平衡向正方向移动
C. MgCl2对热的稳定性比RbCl强
D. 高温下Mg2+得电子的能力比Rb+强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com