
科目: 来源: 题型:
【题目】下列有关生活中常见物质的说法不正确的是
A. 医用酒精是中性消毒剂,能使细菌内蛋白质变性而杀菌
B. 火腿中常加入适量NaNO2作防腐剂、抗氧化剂
C. 用灼烧的方法可以区分羊毛衫和涤纶衫
D. 84消毒液与洁厕灵合用能增强消毒效果
查看答案和解析>>
科目: 来源: 题型:
【题目】钛的化合物如TiO2、Ti(NO3)4、TiCl4、 Ti(BH4)2等均有着广泛用途。
(1)写出Ti的基态原子的外围电子排布式____________。
(2)TiCl4熔点是-25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于_____晶体;BH4-中B原子的杂化类型为____________;
(3)在 TiO2催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO-互为等电子体的分子化学式为_________________。
(4)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2H2O(绿色),两者配位数_____(填“相同”或“不同”),绿色晶体中配体是______。

(5)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为____________。
(6)金属钛内部原子的堆积方式是面心立方堆积方式,如图2。若该晶胞的密度为![]() g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列粒子半径比较中,正确的是( )
A. Na+<Mg2+<Al3+<K+B. S2->Cl->K+>Ca2+
C. O2->S2->Cl->Br-D. F->Li+>Na+>S2-
查看答案和解析>>
科目: 来源: 题型:
【题目】绿矾(![]() )是治疗缺铁性贫血的特效药。某化学兴趣小组对绿矾进行了如下的探究:
)是治疗缺铁性贫血的特效药。某化学兴趣小组对绿矾进行了如下的探究:
I .【制备产品】
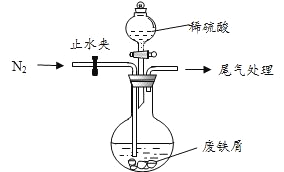
该小组由废铁屑(含少量氧化铜、氧化铁等杂质),用上图所示装置制备![]() 晶体,步骤如下:
晶体,步骤如下:
(1)预处理:先将废铁屑加入到饱和![]() 溶液中洗涤,目的是_____,然后将废铁屑用水洗涤2~3 遍。
溶液中洗涤,目的是_____,然后将废铁屑用水洗涤2~3 遍。
(2)将洗涤后的废铁屑加入到圆底烧瓶中,并持续通入![]() ,
,![]() 的作用是________。
的作用是________。
(3)再加入足量稀硫酸,控制温度 50℃~80℃之间,充分反应后,圆底烧瓶中剩余的固体为_____________。
(4)获取产品:先向步骤(3)中反应后的混合物中加入少许蒸馏水,趁热过滤, ____________。
滤出晶体,用少量冰水洗涤 2~3 次,再用滤纸将晶体吸干,密闭保存。
II.【测定![]() 含量】
含量】
(1)称取上述样品 10.0g,溶于适量的稀硫酸中,配成 100mL 溶液,需要的仪器除天平、胶头滴管、 烧杯、量筒外,还需要的仪器有(填仪器名称)____________________、_______________________。
(2)准确量取 25mL 该液体于锥形瓶中,用 0.1000mol/L ![]() 标准溶液滴定,则滴定终点的判断方法是________________________。
标准溶液滴定,则滴定终点的判断方法是________________________。
(3)用同样的方法滴定 3 次,平均消耗 10.00mL 标准液,该样品中![]() 的质量分数为____________。(已知 Mr(
的质量分数为____________。(已知 Mr(![]() )=278)
)=278)
(4)若测量结果偏小,则可能是在定容时_________________(填“俯视”或“仰视”)读数。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实与水解反应无关的是:
A. 配制CuSO4溶液时加少量稀H2SO4B. 用热的Na2CO3溶液去油污
C. 明矾净水D. 用Na2S除去废水中的Hg2+
查看答案和解析>>
科目: 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
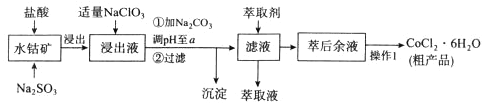
已知:①浸出液含有的阳离子主要有H+、CO2+、Fe2+、Mn2+、Al3+等;
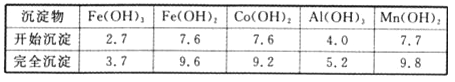
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表(金属离子浓度为0.01 mol/L):
③CoCI2.6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式: 。
(2)写出NaClO3发生反应的主要离子方程式: ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式: 。
(3)惰性电极电解CoCl2溶液的阳极电极反应式为 。
(4)“操作1”中包含3个基本实验操作,它们依次是 、 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是 。
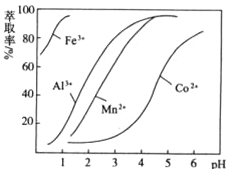
(5)萃取剂对金属离子的萃取率与pH的关系如图向“滤液”中加入萃取剂的目的是 ,其使用的最佳pH范围是 。
A.2.0~2.5 | B.3.0~3.5 |
C.4.0~4.5 | D.5.0~5.5 |
(6)力测定粗产品中CoCl2·H2O的含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知 25 ℃时,几种弱酸的电离常数如下:

25 ℃时,下列说法正确的是( )
A. 等物质的量浓度的各溶液 pH 关系为:pH(![]() )>pH(
)>pH(![]() ) >pH(
) >pH(![]() )>pH(
)>pH(![]() )
)
B. 用 0.1mol/L 的 NaOH 溶液滴定 pH 值相等的![]() 和 HCN 溶液,
和 HCN 溶液, ![]() 消耗的
消耗的![]() 溶液体积 更大
溶液体积 更大
C. ![]() 和
和![]() 的混合溶液中,一定存在
的混合溶液中,一定存在![]()
D. 某浓度的![]() 溶液的 pH=d,则其中由水电离出的
溶液的 pH=d,则其中由水电离出的![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】工业生产中需对空气中的CO进行监测,粉红色的PdCl2溶液可以检验空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀(反应中只有PdCl2作氧化剂)。每生成5.3gPd沉淀,反应转移的电子数为
A. 0.05 NA B. 0.1 NA C. 0.2 NA D. 0.4 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】铋(Bi)的无毒与不致癌性有很多特殊用途,其化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为Bi2S3,含杂质PbO2等)制备Bi2O3的工艺如下:

已知:①25℃时,K sp(FeS)=6.0×10-18 K sp(PbS)=3.0×10-28
K sp(Bi2S3)=1.6×10-20
②溶液中的离子浓度小于等于10-5mol L-1时,认为该离子沉淀完全。
(1)Bi位于元素周期表第六周期,与N、P同族,Bi的原子结构示意图为________。
(2)“浸出”时Bi2S3与FeCl3溶液反应的化学方程式为___________________;反应液必须保持强酸性,否则铋元素会以BiOCl(碱式氯化铋)形式混入浸出渣使产率降低,原因是________(用离子方程式表示)。
(3)“母液1”中通入气体X后可循环利用,气体X的化学式为________。
(4)“粗铋”中含有的杂质主要是Pb,通过熔盐电解精炼可达到除杂的目的,其装置如右图。电解后,阳极底部留下的为精铋。阳极材料为____________,阴极的电极反应式为________________。

(5)碱式硝酸铋直接灼烧也能得到Bi2O3,上述工艺中转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是________。“母液2”中可回收的主要物质是________。
(6)25℃时,向浓度均为0.1mol·L-1的Fe2+、Pb2+、Bi3+的混合溶液中滴加Na2S溶液,当Pb2+恰好沉淀完全时,所得溶液中c(Fe2+):c(Bi3+)=__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com