
科目: 来源: 题型:
【题目】(1)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。

①在图示的转化中,化合价不变的元素是_________________。
②反应中当有1mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为_________________。
(2)已知硫有多种同素异形体,如S2 、S4、 S6 、S8等。H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,H2S在高温下分解反应的化学方程式为_______________________。

(3)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题20图- 1和题20图- 2所示。

(3)溶液的pH对吸附剂X表面所带电荷有影响。pH =7. 1时, 吸附剂X表面不带电荷; pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如题20图-3所示。

①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是____________。
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为___________。 提高吸附剂X对三价砷去除效果可采取的措施是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000 mol·L-1HCl 标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:

(1)若甲同学在实验过程中,记录滴定前滴定管内液面读数为2.10 mL,滴定后液面如图,则此时消耗HCl标准溶液的体积为________ mL。
(2)乙学生做了2组平行实验,数据记录如下:
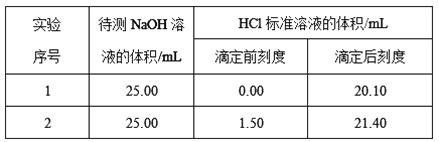
据此计算出待测NaOH溶液的物质的量浓度为____ mol·L-1(小数点后保留四位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:

(1)O点为什么不导电_________________;
(2)a、b、c三点溶液c(H+)由小到大的顺序 是___________;
(3)a、b、c三点中醋酸的电离程度最大的是 _______点。
(4)若要把b点溶液中c(CH3COO-)、c(OH-)均减小,可采用的方法是___________(选择正确的选项)
A.加水 B.加NaOH C.加H2SO4 D.加Na2CO3
(5)若要使c点溶液中的c(CH3COO-)提高,可以采取下列措施中的________(填字母 序号)。
A.加热 B.加NaOH固体 C.加水 D.加固体CH3COONa
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液,若氯气与KOH恰好完全反应,产物中可能有KCl、KClO、KClO3,且c(Cl-)/c(ClO-)的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( )
A. 若某温度下,反应后c(Cl-)/c(ClO-)=11,则溶液中c(ClO-)/ c(ClO3-)=2: 1
B. 参加反应的氯气的物质的量等于a/2 mol
C. 改变温度,反应中转移电子的物质的量ne的范围:a/2mol≤ne≤5a/6 mol
D. 改变温度,产物中KClO3的最大理论产量为a/7mol
查看答案和解析>>
科目: 来源: 题型:
【题目】NaClO2是一种离效消毒剂、漂白剂在实验室中可用如图装置制备。.
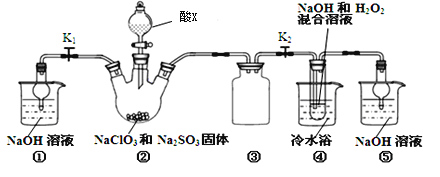
(1)装置②中酸X可以为_____________。
A.盐酸 B.H2SO4 C.HNO3 D.H2C2H4溶液
(2)写出装置②中产生ClO2的离子方程式_____________________。
(3)装置③的作用是_____________,装置④采用冷水欲的原因是__________________。
(4)由装置④反应后的溶液可得到NaClO2晶体,其实验步骤为:
ⅰ.减压,蒸发结晶;ⅱ.___________;ⅲ.热水洗涤;ⅳ.低温干燥,得到成品
(已知低温时NaClO2饱和溶液中会析出NaClO2·3H2O。)
(5)ClO2可用于氧化工厂污水中所含CN-,生成两种无毒无害的气体,写出其离子反应方程式__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应属于消去反应的是 ( )
A. 溴乙烷与NaOH的乙醇溶液共热 B. 在液溴与苯的混合物中撒入铁粉
C. 溴乙烷与NaOH的水溶液共热 D. 以乙烯和HCl为原料制备氯乙烷
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产生活密切相关。下列说法正确的是
A. 阻燃剂Al(OH)3受热分解时放出能量
B. 蚕丝、涤纶、棉花的主要成分均为蛋白质
C. 油脂在长期贮存过程中与微生物、酶和空气中的氧气作用会发生酸败
D. 硅太阳能电池与铜锌原电池工作时均由化学能转变为电能
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
⑩ |
(1)⑧、⑩的最高价含氧酸的酸性由强到弱的顺序是__________________。③的最高价氧化物为__________;⑨的最高价含氧酸是__________(均填化学式)
(2)④、⑤、⑥的形成的简单离子半径的大小顺序___________。(用离子符号表示)⑤与水反应的离子方程式___________。
(3)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:__________。
(4)在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H2反应的限度_______(选填“更大”“更小”或“相同”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应进行到一定程度会达到化学平衡状态,如K2Cr2O7溶液中存在平衡:Cr2![]() (橙色)+H2O
(橙色)+H2O![]() 2Cr
2Cr![]() (黄色)+2H+。平衡时各种物质含量保持不变,达到一种相对的静止(如平衡时,每消耗1molH2O同时也会生成1molH2O)。外界条件改变时,平衡状态会被破坏而发生移动(如消耗的水多于生成的水,则平衡向正向移动),平衡移动符合勒夏特列原理,即如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动。现在用K2Cr2O7溶液进行下列实验:
(黄色)+2H+。平衡时各种物质含量保持不变,达到一种相对的静止(如平衡时,每消耗1molH2O同时也会生成1molH2O)。外界条件改变时,平衡状态会被破坏而发生移动(如消耗的水多于生成的水,则平衡向正向移动),平衡移动符合勒夏特列原理,即如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动。现在用K2Cr2O7溶液进行下列实验:

已知:C2H5OH遇到氧化剂容易被氧化。
结合实验,下列说法不正确的是 ( )
A. ①中溶液橙色加深,③中溶液变黄 B. ②中Cr2![]() 被C2H5OH还原
被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性弱 D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com