
科目: 来源: 题型:
【题目】汽车尾气是造成雾霾天气的重要原因之一,尾气中的主要污染物为CxHy、NO、CO、SO2及固体颗粒物等。研究汽车尾气的成分及其发生的反应,可以为更好的治理汽车尾气提供技术支持。请回答下列问题:
(1)治理尾气中NO和CO的一种方法是:在汽车排气管上装一个催化转化装置,使二者发生反应转化成无毒无污染气体,该反应的化学方程式是 。
(2)活性炭也可用于处理汽车尾气中的NO。在1L恒容密闭容器中加入0.1000 molNO和2.030 mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量以及容器内压强如下表:

根据上表数据,写出容器中发生反应的化学方程式 并判断p 3.93MPa(用“>”、“<"或“=”填空)。计算反应体系在200℃时的平衡常数Kp (用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
(3)汽车尾气中的S02可用石灰水来吸收,生成亚硫酸钙浊液。常温下,测得某纯CaS03与水形成的浊液pH为9,已知Kal(H2S03)=1.8×10-2 ,Ka2(H2S03)=6.0 ×10-9,忽略SO32-的第二步水解,则Ksp(CaS03)= 。
(4)尾气中的碳氢化合物含有甲烷,其在排气管的催化转化器中可发生如下反应CH4(g)+H20(1)=CO(g)+3H2 (g) △H=+250.1 kJ/mol。已知CO(g)、H2 (g)的燃烧热依次为283.0kJ/mol、285.8 kJ/mol,请写出表示甲烷燃烧热的热化学方程式 。以CH4 (g)为燃料可以设计甲烷燃料电池,该电池以稀H2 S04作电解质溶液,其负极电极反应式为 ,已知该电池的能量转换效率为86. 4%,则该电池的比能量为 kW.h.kg-1(结果保留1位小数,比能量=![]() ,lkW·h= 3. 6×1 06J) 。
,lkW·h= 3. 6×1 06J) 。
查看答案和解析>>
科目: 来源: 题型:
【题目】“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2 +2H2O=2Mg(OH)2。下列关于该电池的说法错误的是
A. 活性炭作为正极 B. 食盐水作为电解质溶液
C. 电池工作时镁片逐渐被消耗 D. 实现了电能向化学能的转化
查看答案和解析>>
科目: 来源: 题型:
【题目】锰锌铁氧体可用于隐形飞机上吸收雷达波涂料。现以废旧锌锰电池为原料制备锰锌铁氧体的主要流程如下:

(1)碱性锌锰干电池(电解质为 KOH)中 MnO2参与反应的电极反应式为______________________。
(2)用硫酸酸浸时,为了提高浸取率可采取的措施有________________________(任写一点)。酸浸时,二氧化锰被双氧水还原的化学方程式为___________________。
(3)活性铁粉除汞时,铁粉的作用是______________ (填“氧化剂” 或“还原剂” 或“吸附剂” ) 。
(4)除汞是以氮气为载气吹入滤液带出汞蒸汽经 KMnO4溶液进行吸收而实现的。 在不同pH下,KMnO4溶液对Hg的吸收率的影响及主要产物如图所示。

①请根据该图给出 pH对汞吸收率影响的变化规律: __________________________。
②试分析在强酸性环境下 Hg 的单位时间吸收率高的原因可能是: _______________。
(5)经测定滤液成分后同时加入一定量的 MnSO4和铁粉的目的是________________。
(6)当 x=0.2 时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该铁氧体组成_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机物的说法,正确的是
A. 将红热的铜丝迅速插入无水乙醇中可将乙醇氧化为乙醛
B. 纤维素、橡胶和光导纤维都属于有机高分子化合物
C. 乙烷、乙烯和苯都可发生加成反应
D. 将乙醇和乙酸混合加热可以制备乙酸乙酯
查看答案和解析>>
科目: 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。

下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.c点,两溶液中含有相同量的OH-
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目: 来源: 题型:
【题目】下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污
B.加热稀醋酸溶液其pH 稍有减小
C.配置FeCl3溶液时,加入少量HCl,以防止溶液浑浊
D.水中加入明矾可以净化水
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示3套实验装置,分别回答下列问题。

(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6] 溶液,即可观察到铁钉附近的溶液变蓝色沉淀,表明铁被 (填“ 氧化”或“还原”);向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。
(2)装置2中的石墨是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为 极;甲烧杯中铁电极的电极反应为 。
②乙烧杯中电解反应的离子方程式为 。
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为 mL 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验中,直接采用沾有水滴的仪器,对实验结果没有影响的是( )
A.氨的喷泉实验:烧瓶
B.实验用氯酸钾固体制取氧气:试管
C.酸碱中和滴定:锥形瓶
D.酸碱中和滴定:滴定管
查看答案和解析>>
科目: 来源: 题型:
【题目】有一种细菌在酸性水溶液中,有氧气的情况下,可以将黄铜矿(主要成分是CuFe![]() ,含少量杂质SiO2)氧化为硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下:
,含少量杂质SiO2)氧化为硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下:
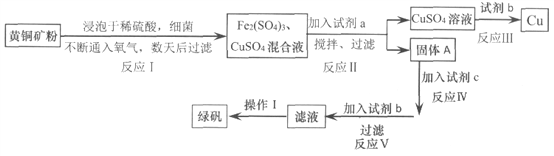
已知:
Fe2+ | Cu2+ | Fe3+ | |
开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
回答下列问题:
(1)试剂a是_________,调节溶液的pH值,为使Fe3+完全沉淀,合适pH的范围是_______。
(2)试剂b为________,请写出反应III的离子方程式________________。
(3)固体A成份是________。
(4)欲从滤液中获得绿矾晶体,操作I应为________________、洗涤干燥。
(5)反应I中参加反应的n(CuFeS2):n(O2)=________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com