
科目: 来源: 题型:
【题目】下列物质的沸点的排列顺序正确的是
①丁烷 ②2-甲基丙烷 ③正戊烷 ④2-甲基丁烷 ⑤2,2-二甲基丙烷
A. ①>②>③>④>⑤ B. ⑤>④>③>②>①
C. ③>④>⑤>①>② D. ②>①>⑤>④>③
查看答案和解析>>
科目: 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。
(1)实验室在40℃、pH﹦4的条件下用Na2SO3溶液和SO2反应制取Na2S2O5:Na2SO3+SO2=Na2S2O5实验时先用CO2气体尽可能排除装置内空气的目的是_____________。
(2)若制备19 g Na2S2O5至少需标准状况下SO2_____________L。
(3)为了检验某抗氧化剂产品中Na2S2O5的质量分数,某研究小组进行如下实验:
步骤I:称取抗氧化剂产品0.2 g,将其加入到含I2浓度为0.05000 mol·L1 的100 mL稀盐酸和碘水的混合溶液中,然后加水稀释至500 mL。
步骤II:取稀释后的溶液100 mL,加入几滴淀粉溶液,用0.1000 mol·L1 Na2S2O3标准溶液进行滴定,共消耗Na2S2O3标准溶液12.00 mL(2S2O32- + I2=2I- + S4O62-)。
①写出步骤I中Na2S2O5和I2反应的离子方程式_____________。
②计算抗氧化剂产品中Na2S2O5质量分数,写出计算过程_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物F是合成降血脂药物阿伐他汀的重要中间体,其合成路线如下:

(1)化合物D中的含氧官能团为酰胺键、_____________和_____________(填官能团名称)。
(2)反应①→⑤中,属于取代反应的是_____________(填序号)。
(3)此合成路线中F的产率不高,原因是反应①中还有一种和B互为同分异构体的副产物生成,其结构简式为_____________。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:_____________。
I.分子中含有一个含氧5元环;II.可使溴水褪色;
III.核磁共振氢谱显示氢原子的峰值比为1︰1︰2︰3。
(5)请以CH3COOC2H5和HCHO为原料制备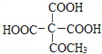 ,写出相应的合成路线流程图________(无机试剂任用,合成路线流程图示例见本题题干)。
,写出相应的合成路线流程图________(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲苯是重要的化工原料。下列有关甲苯的说法错误的是
A.分子中碳原子一定处于同一平面B.可萃取溴水的溴
C.与H2混合即可生成甲基环己烷D.光照下与氯气发生取代反应
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知NO2和N2O4的结构式如右图所示。已知:N—N的键能为a kJ/mol,NO2和N2O4中N=O键键能分别是b kJ/mol和c kJ/mol。写出NO2转化为N2O4的热化学方程式________________(△H用a、b、c的代数式表示)。

(2)在100℃时,将0.4mol NO2放入2L的真空容器中发生反应:2NO2![]() N2O4。测得容器内气体的物质的量随时间变化如下表:
N2O4。测得容器内气体的物质的量随时间变化如下表:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
①上述条件下,前20s内以NO2表示的平均化学反应速率为_________________________;达到平衡状态时,NO2的转化率是________。
②n2_______ n3(填“>”、“=”、“<”)。
③80s时,向容器内加入NO2和N2O4各0.24mol,化学平衡将_________(填“向正反应方向移动”、“ 向逆反应方向移动”、“不移动”)。
④若将NO2的起始物质的量改为0.2mol,在相同条件下进行实验,要想达到与上述平衡相同的平衡状态,则起始时还需要加入适量的N2O4气体,则N2O4的浓度为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一恒温恒容容器内发生反应:C(s)+H2O(g) ![]() CO(g)+H2(g)。下列条件不能确定上述可逆反应已达到化学平衡状态的是
CO(g)+H2(g)。下列条件不能确定上述可逆反应已达到化学平衡状态的是
A. 体系的压强不再发生变化
B. 气体密度不再发生变化
C. 生成n mol CO的同时消耗n mol H2O
D. 1 mol H—H键断裂的同时断裂2 mol H—O键
查看答案和解析>>
科目: 来源: 题型:
【题目】前四周期元素X、Y、Z、M、E的原子序数依次增大,其中元素X的基态原子有3个不同的能级,且3个能级中的电子数均相等。元素Y的核外p电子总数比s电子总数少1。元素Z的核外s电子总数与p电子总数相等,且与Y元素在同一周期。元素M的主族序数与周期数的差为4。元素E位于周期表的第10列。
(1)元素X、Y、Z的第一电离能由小到大的顺序为_____________(用元素符号表示)。
(2)常温下,配合物Fe(XZ)5为黄色液体,易溶于非极性溶剂,熔点为215K,沸点为376K。据此推断Fe(XZ)5 晶体属于_____________晶体。配合物Fe(XZ)5的中心原子的基态核外电子排布式为_____________。
(3)XZM2分子中所有原子最外电子层均形成8电子稳定结构,XZM2分子中σ键和π键的个数比为_____________,中心原子的杂化方式为_____________。

(4)E和La的合金是目前使用广泛的储氢材料,在我国已实现了产业化。该合金的晶胞结构如图所示,则该晶体的化学式为_____________(用元素符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com