
科目: 来源: 题型:
【题目】甲醇是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业上常用CO和H2合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) △H
CH3OH(g) △H
①已知:aA(g)+bB(g)=xX(g)+yY(g) △H=x△Hm[X(g)]+y△Hm[Y(g)]-a△Hm[A(g)]-b△Hm[B(g)]。
△Hm[X(g)]表示X(g)的摩尔生成焓,其余类推。25℃101kPa时,CO(g)、H2(g)、CH3OH(g)的摩尔生成焓分别为-110.5kJ·mol-1、0、-201.2kJ·mol-1,则上述反应的△H=_____。
②某温度下,向容积为2L的密闭容器中加入1molCO和2molH2,发生上述反应,CO转化率随时间的变化如图所示:
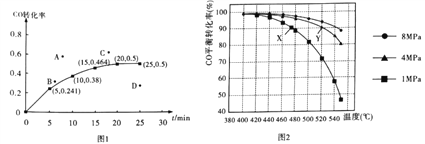
该温度下反应的平衡常数为_______;若起始压强为9MPa,则10min时容器中的压强为_______;若保持其它条件不变,起始时加入2molCO和2molH2,达到平衡,相应的点可能是上图A、B、C、D中的____。
③若只改变反应的一个条件,能使平衡体系中![]() 增大的措施有_______________(答出两点即可)。
增大的措施有_______________(答出两点即可)。
④若投料时CO与H2的物质的量之比恒定,温度、压强对CO平衡转化率的影响如图所示,如图中X点的v(逆)____________Y点的v(正)(填“>”“<”或“=”),理由是_____________。
(2)工业上常用CH3OH来制备HCOOH(甲酸)。已知25℃时,0.1mol·L-1HCOOH溶液的pH为2.3,则甲酸的电离度计算式为______;向0.1mol·L-1HCOOH溶液中加水或加入少量HCOONa晶体时,会引起同样变化的是_______(填编号)。
A.溶液的pH增大 B.HCOOH的电离程度增大
C.溶液的导电能力减弱 D.溶液中c(OH-)减小
查看答案和解析>>
科目: 来源: 题型:
【题目】现用邻苯二甲酸氢钾标准溶液来测定某NaOH溶液的浓度,进行如下操作:
步骤I:用天平精确称取5.207g邻苯二甲酸氢钾(相对分子质量为204.2)固体配成250mL标准溶液。
步骤Ⅱ:移取25.00mL标准溶液于250mL锥形瓶中,加入1~2滴酚酞试液,用NaOH待测溶液滴定至终点。再按上述方法重复操作2次。
(1)操作I中,所得邻苯二甲酸氢钾标准溶液的物质的量浓度是__________________________。
(2)滴定结果记录如下:
滴定次数 | 标准溶液的体积/mL | 待测溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.04 |
2 | 25.00 | 2.00 | 21.98 |
3 | 25.00 | 0.20 | 20.20 |
①滴定过程中发生反应的化学方程式是(有机物写结构简式)____________________。
②待测NaOH溶液的物质的量浓度为___________。
(3)根据步骤Ⅱ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH待测溶液进行滴定,则测得NaOH溶液的浓度_______(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH待测溶液的体积______(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察_______________。
④滴定终点时溶液的颜色如何变化?____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】随原子序数递增,x、y、z、……等八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如下图所示。

下列说法正确的是
A. x元素在周期表中的位置是第二周期ⅠA族
B. 离子半径:g2->h->d2->e+>f3+
C. 最高价氧化物对应水化物的酸性:y>z
D. 气态氢化物的热稳定性:g>h
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关C2H2和C6H6的叙述错误的是( )
A. 二者的碳元素的质量分数相同
B. 在标准状况下,等体积的两种物质含有的分子数相等
C. 等物质的量时,二者质量之比为![]() =
=![]()
D. 等质量时,二者完全燃烧消耗相同状况下的氧气体积相等
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,调节2.0×10-3 mol/L氢氟酸水溶液的pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示。请结合图中信息回答下列问题:
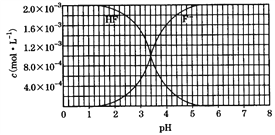
(1)HF电离平衡常数的表达式:Ka=_________。室温下,向HF溶液中滴加NaOH溶液至pH=3.4时,c(F-)∶c(HF) =_______。HF 的电离常数值为_______。
(2)将4.0×10-3mol/L的HF溶液与4.0×10-4mol/LCaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生:
______________________________。[已知Ksp(CaF2)=1.5×10-10 ]
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得NaHSO3溶液以实现吸收液的回收再利用,装置如图所示,则工作一段时间后,下列说法正确的是

A. 电源a端是正极
B. 阴极区的pH减小
C. 阳极的电极反应式为HSO3--2e-+H2O=SO42-+3H+
D. 电路中每通过0.2mol电子,能产生2.24LH2
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,①和②为两个体积相同的固定容器,图中“![]() ”和“
”和“![]() ”分别表示氢原子和氧原子,则下列说法正确的是( )
”分别表示氢原子和氧原子,则下列说法正确的是( )
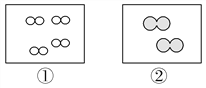
A. 若①中的H2为1 mol,则②中所含原子总数为3.01×1023个
B. ①和②中气体的质量之比为1∶8
C. H2、O2均能发生化合反应,但不能发生置换反应
D. 两容器的温度和压强均相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是
A.淀粉、蔗糖和葡萄糖在一定条件下都能发生水解反应
B.油脂在碱性条件下水解可得到高级脂肪酸和丙三醇
C.棉、麻、羊毛完全燃烧都只生成CO2和H2O
D.蛋白质是结构复杂的高分子化合物,分子中一定含有C、H、O、N四种元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com