
科目: 来源: 题型:
【题目】以天然气代替石油生产液体燃料和基础化学品是当前化学研究和发展的重点。
(1)我国科学家创造性地构建了硅化物晶格限域的单中心铁催化剂,成功实现了甲烷一步高效生产乙烯、芳香烃Y和芳香烃Z等重要化工原料,实现了CO2的零排放,碳原子利用率达100%。已知Y、Z的相对分子质量分别为78、128,其一氯代物分别有1种和2种。
①有关化学键键能数据如表中所示:
化学键 | H-H | C=C | C-C | C≡C | C-H |
E(kJ/mol) | 436 | 615 | 347.7 | 812 | 413.4 |
写出甲烷一步生成乙烯的热化学方程式:_________________________,反应中硅化物晶格限域的单中心铁催化剂的作用是________________________;
②已知:原子利用率=期望产物总质量/反应物总质量×100%,则甲烷生成芳香烃Y的原子利用率为___________;
③生成1 mol Z产生的H2约合标准状况下________L。
(2)如图为乙烯气相直接水合法制备乙醇过程中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
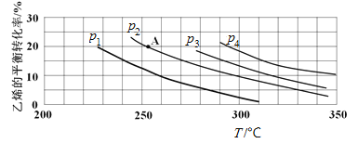
①若p2=8.0 MPa,列式计算A点的平衡常数Kp=____________(用平衡分压代替平衡浓度计算;分压=总压×物质的量分数;结果保留到小数点后两位);
②该反应为__________(填“吸热”或“放热”)反应,图中压强(p1、p2、p3、p4)的大小关系为____________,理由是________________;
③气相直接水合法常采用的工艺条件:磷酸/硅藻土为催化剂,反应温度为290℃,压强为6.9 MPa,n(H2O)∶n(C2H4)=0.6∶1。乙烯的转化率为5%,若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有______________(任写两条)。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用。
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1 kJ·mol1
CO(g)+3H2(g) △H1=+206.1 kJ·mol1
②2H2(g)+ CO(g)![]() CH3OH(l) △H2=128.3 kJ·mol1
CH3OH(l) △H2=128.3 kJ·mol1
③2H2(g)+ O2(g)![]() 2H2O(g) △H3=483.6 kJ·mol1
2H2O(g) △H3=483.6 kJ·mol1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为__________________________。
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/mol·L1 | H2O初始浓度/mol·L1 |
1 | 400 | p | 3.0 | 7.0 |
2 | t | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
①实验2和实验3相比,其平衡常数关系是K2__________K3(填“>”“<”或“=”)。
②将等物质的量的CH4和水蒸气充入1 L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10 mol,则CH4的转化率为__________。
(3)科学家提出由CO2制取C的太阳能工艺如图1所示。
①“重整系统”发生的反应中n(FeO)∶n(CO2)=6∶1,则FexOy的化学式为______________。
②“热分解系统”中每分解l mol FexOy,转移电子的物质的量为________。

(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。若某溶液中溶质的浓度为1×103 mol·L1,则该溶液中溶质的pC=lg(1×103)=3。如图2为25℃时H2CO3溶液的pCpH图。请回答下列问题 (若离子浓度小于105 mol·L1,可认为该离子不存在):
①在同一溶液中,H2CO3、![]() 、
、![]() _____________(填“能”或“不能”)大量共存。
_____________(填“能”或“不能”)大量共存。
②求H2CO3一级电离平衡常数的数值Ka1=________________。
③人体血液里主要通过碳酸氢盐缓冲体系![]() 可以抵消少量酸或碱,维持pH=7.4。当过量的酸进入血液中时,血液缓冲体系中的
可以抵消少量酸或碱,维持pH=7.4。当过量的酸进入血液中时,血液缓冲体系中的![]() 最终将_______。
最终将_______。
A.变大 B.变小 C.基本不变 D.无法判断
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应。

请回答下列问题:
(1)反应A、B、C、D、E中属于氧化还原反应的是_______(填字母)。
(2)根据已学过的知识及这5个反应比较H+、Fe2+、Ag+的氧化性强弱:_________。
(3)用洁净的烧杯取少量反应A后的溶液,用酒精灯小心加热至沸腾,发现可制得一种红褐色胶体。写出生成红褐色胶体的离子方程式:________。在加热过程中__ (填“有”或“没有”)电子转移。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于碱金属单质的描述正确的是( )
A. 碱金属都可以保存在煤油中
B. 碱金属与水反应,均浮在水面上
C. 在空气中加热均可生成多种氧化物
D. 硬度小、密度小、熔点低
查看答案和解析>>
科目: 来源: 题型:
【题目】碳及其化合物在能源、材料等方面具有广泛的用途。回答下列问题:
(1)天然气是目前应用较为广泛的能源之一,天然气中除含主要成分甲烷外,还含有乙烷、丙烷等,乙烷的电子式为 。
(2)碳酸和草酸均为二元弱酸,其电离均为分步电离,二者的电离常数如下表:
H2CO3 | H2C2O4 | |
K1 | 4.2×107 | 5.4×102 |
K2 | 5.6×1011 | 5.4×105 |
①向碳酸钠溶液中滴加少量草酸溶液所发生反应的离子方程式为 。
②浓度均为0.1 mol·L1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液,其溶液中H+浓度分别记作c1、c2、c3、c4。则四种溶液中H+浓度由大到小的顺序为 。
(3)常温时,C和CO的标准燃烧热分别为394.0 kJ·mol1、283.0 kJ·mol1,该条件下C转化为CO的热化学方程式为 。
(4)氢气和一氧化碳在一定条件下可合成甲醇,反应如下:
2H2(g)+CO(g)![]() CH3OH(g) ΔH=Q kJ·mol1
CH3OH(g) ΔH=Q kJ·mol1
①该反应在不同温度下的化学平衡常数(K)如下表:
温度/℃ | 250 | 300 | 350 |
K/L2·mol2 | 2.041 | 0.270 | 0.012 |
由此可判断Q (选填“ >”或“<”)0。
②一定温度下,将6 mol H2和2 mol CO充入体积为2 L的密闭容器中,10 min反应达到平衡状态,此时测得c(CO)=0.2 mol·L1,该温度下的平衡常数K= ,0~10 min内反应速率v(CH3OH)= 。
③在两个密闭容器中分别都充入20 mol H2和10 mol CO,测得一氧化碳的平衡转化率随温度(T)、压强(p)的变化如图所示:

A、B两点的压强大小关系:p1 (选填“ >”、“=”或“<”)p2。若A点对应容器的容积为20 L,则B点对应容器的容积为 L。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n。己知:电池的 “理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是( )

A. 采用多孔电极的目的是提髙电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属一空气电池,Al -空气电池的理论比能量最高
C. M-空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne-=4M(OH)n
D. 在M-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目: 来源: 题型:
【题目】“物质的量”是一个将微观粒子与宏观物质联系起来的物理量。下列说法不正确的是( )
A. 1 mol NaCl的体积为22.4 L
B. 1 mol H2含有6.02×1023个氢分子
C. 1 mol O2含有2 mol氧原子
D. 标准状况下,1 mol H2的体积为22.4 L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A. 含金属元素的离子都是阳离子
B. 利用丁达尔现象可以区分溶液和胶体
C. 某元素从游离态变为化合态时,该元素可能被氧化
D. 同温同压下,相同体积的气体含有相同数目的分子数
查看答案和解析>>
科目: 来源: 题型:
【题目】能源是人类生存和发展的重要支柱,化学在能源的开发与利用方面起着十分重要的作用。某学习小组按如下图所示装置探究化学能与电能的相互转化:
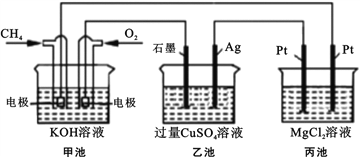
(1) 甲池是_____装置,通入CH4气体的电极上的反应式为_____。乙池中SO42- 移向_____电极(填“石墨”或“Ag”)
(2) 当甲池消耗标况下33.6LO2时,电解质KOH的物质的量变化_____mol,乙池若要恢复电解前的状态则需要加入_____g _____(填物质名称)。
(3) 丙池中发生的电解反应的离子方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com