
科目: 来源: 题型:
【题目】由金属Na、Cu、C、N、B等元素组成的物质在生活和工业上有着广泛用途。
(1)基态Cu+的外围电子轨道式为_______。
(2)H3BNH3是储氢材料,其制备原理为:3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3,其中(HB=NH)3是一种六元环状化合物。化合物H3BNH3中B原子的杂化方式为_______;1个(HB=NH)3分子中含有 ___个σ键。
(3) B、C、N、O原子的第一电离能由大到小的顺序为_____________________。
(4)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为____(填字母)。
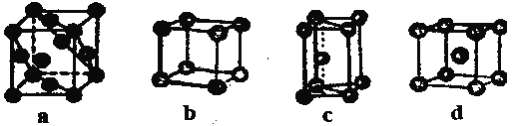
(5)已知NaCl的摩尔质量为Mg·mol-1,密度为pg·㎝-3,阿伏加德罗常数为NA mol-1,在NaCl晶体中,两个距离最近的Cl-中心间的距离为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图象所表示的化学知识中不正确的是
A. 分散系的分类![]()
B. 稀释浓氢氧化钠溶液的过程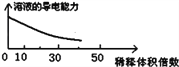
C. 向碳酸钠溶液中逐滴滴加盐酸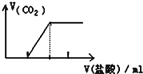
D. 向盐酸和氯化镁混合溶液中滴加氢氧化钠溶液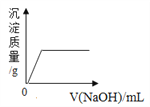
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨反应在工业生产中的大量运用,满足了人口的急剧增长对粮食的需求,也为有机合成提供了足够的原料——氨。合成氨反应为:N2(g)+3H2(g) ![]() 2NH3(g)。若将标准状况下11.2L的N2与足量的H2进行反应,并将得到的气体通入水中,用1mol/L的硫酸完全中和成正盐,消耗硫酸的体积为200mL。
2NH3(g)。若将标准状况下11.2L的N2与足量的H2进行反应,并将得到的气体通入水中,用1mol/L的硫酸完全中和成正盐,消耗硫酸的体积为200mL。
(1)实验室用98%浓硫酸(密度为1.84g/ml)配制1mol/L的稀硫酸。
①该浓硫酸中H2SO4的物质的量浓度为______________;
②配制时选用的仪器除了量筒、胶头滴管、烧杯外,还需要的仪器有_______________;
③需要量取的浓硫酸的体积为_________。
(2)若消耗1mol/L硫酸的体积小于200mL,则可能的原因是__________
A. 未经冷却就将硫酸转移至容量瓶 B.定容时俯视刻度线
C.往容量瓶转移时,有少量液体溅出 D.定容时仰视刻度线
E.容量瓶未干燥即用来配制溶液
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
(3)该反应得到的氨气的产率为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】水煤气的主要成分是氢气和一氧化碳,由水蒸气和炽热的无烟煤或焦炭作用而得.是重要的化工原料,可用于合成甲醇和甲醚等有机化合物,已知:
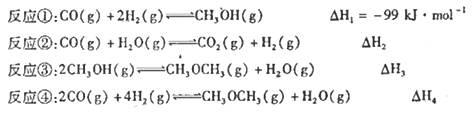
(1)△H1= ______(用△H2、△H3、△H4)。
(2)反应②的存在,可大大提高CH30CH3的产率,原因是: ________。
C0(g)和H2(g)以物质的量之比1:2混合,一定条件下在1L固定容积内发生反应①,下图表示温度分别为300℃、500℃的密闭容器中,甲醇的物质的量与时间的关系。回答下列问题:

①C、D两点平衡常数KC _____KD(填>、<、= )。
②在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2下列有关该体系的说法正确的是 _______。
a. 正反应速率加快,逆反应速率也加快
b.甲醇的物质的量增加
c.重新平衡时n(H2)/n(CH3OH)增大
(4)温度为T时,向容积1L的密闭容器甲、乙中分别充入一定量的CO(g)和H20(g),发生反应②,相关数据如下:

①甲容器中,反应在t1min内的平均速率v(H2)= ____mol/(Lmin)。
②乙容器中,a=_____mol。
③解释降低温度使C02平衡浓度增大的原因___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
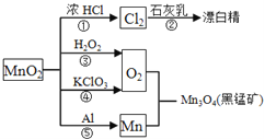
A. 反应①②③④⑤均属于氧化反应和离子反应
B. 反应⑤说明该条件下铝的还原性强于锰
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1︰1
D. 反应①中氧化剂与还原剂的物质的量之比为1︰4
查看答案和解析>>
科目: 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO是生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)几种共价键的键能如下表所示:
化学键 | O=O | H—H | O—H |
键能(kJ/mol) | 496 | 436 | 462 |
已知:O2(g)+2C(s)=2CO(g) △H= -220kJ·mol-1,则H2O(g)+C(s) = CO(g)+H2(g) △H=___ kJ·mol-1。
(2)200℃时,将物质的量均为1mol的CO2和C(s)加入2L的密闭容器中,在一定条件下发生反应:CO2(g)+C(s) ![]() 2CO(g) △H,平衡时CO的体积分数为40%。
2CO(g) △H,平衡时CO的体积分数为40%。
①下列事实能够说明该反应达到平衡状态的是____________。
a.混合气体的平均相对分子质量不变
b.该反应的△H不变
c. CO2和CO的生成速率相等
d.混合气体的密度不变
②达到平衡时CO2的转化率为__________________。
③若在300°C时,将物质的量均为lmol的CO2和C(s)加入1L的密闭容器中,平衡时CO的体积分数为50%,则该反应的△H_____0 (填“>”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质.下列实验现象和结论一致且正确的是
A. 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B. 溶液呈黄绿色,且有刺激性气味,说明有HClO分子存在
C. 加入AgNO3溶液产生白色沉淀,说明有Cl-分子存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
科目: 来源: 题型:
【题目】某元素原子最外层只有1个电子,它跟氯元素相结合时,所形成的化学键是( )
A. 一定是共价键 B. 一定是离子键
C. 可能是共价键,也可能是离子键 D. 可能不形成化学键
查看答案和解析>>
科目: 来源: 题型:
【题目】—种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中的有机物可用C6H10O5表示。有关说法正确的是

A. b电极为该电池的负极
B. b电极附近溶液的pH增大.
C. a 电极反应式:C6H1005 -22e- +6H20 =6CO2↑ +22H+
D. 中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com