
科目: 来源: 题型:
【题目】常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,O、B、C、D分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )
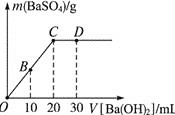
A. 硫酸溶液的体积为20 mL
B. B时刻溶液中SO42—的浓度约为0.125 mol·L-1
C. D时刻溶液为碱性
D. 溶液的导电能力:C<D<B<O
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下CH4、HCl、H2S、NH3均为气体。在标准状况下分别有①13.4 L CH4 ②1 mol HCl分子 ③27.2 g H2S ④2.408×1023个NH3分子,下列说法正确的是
A. 体积:②>③>④>① B. 密度:②>③>①>④
C. 质量:②>③>④>① D. H原子个数:①>③>④>②
查看答案和解析>>
科目: 来源: 题型:
【题目】美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈V形,如图所示(图中箭头代表单键)。下列有关该物质的说法中正确的是

A. 每个N5+中含有35个质子和36个电子 B. 该离子中只含有非极性键
C. 该离子中含有2个π键 D. N5+与PO43-互为等电子体
查看答案和解析>>
科目: 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大。A的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是_____ (填元素符号),e的价层电子排布图为__________。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ________ ;分子中既含有极性共价键、又含有非极性共价键的化合物是__________(填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是___;酸根呈三角锥结构的酸是 _____________ 。(填化学式)
(4)e和c形成的一种离子化合物的晶体结构如图1,则e离子的电荷为__________。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示)。

该化合物中阴离子为 ______ ,阳离子中存在的化学键类型有_____________ ;该化合物加热时首先失去的组分是________ ,判断理由是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化铝(AlN)陶瓷是一种类金刚石氮化物的新型无机非金属材料,最高可稳定到2200℃.导热性好,热膨胀系数小,是良好的耐热冲击材料.抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料.制取原理为:Al2O3 + 3C + N2![]() 2AlN + 3CO
2AlN + 3CO
(1)氮化铝的晶体类型为___________。
(2)制取氮化铝要用较为纯净的N2,N2的电子式为____________。实验室中制备少量氮气
的基本原理是:NH4Cl + NaNO2 =NaCl + 2H2O + N2↑。为了得到较纯净的N2,最好的收集方法是____________。
(3)氮化铝抗酸能力极强,但抗碱蚀能力差,它能与氢氧化钠溶液反应生成NaAlO2和能使湿润红色石蕊试纸变蓝的气体,其化学反应方程式为:___________________
(4)工业上制得的AlN中含有Al2O3 、C杂质,取含杂质的粗氮化铝10.00g于某容器,加入足量浓硫酸,加热,收集到672mL气体(已折算成标准状况)。则该粗氮化铝中碳的质量分数为___________
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列化学方程式中,能用离子方程式H+ + OH— = H2O表示的是
A.H2CO3 + 2NaOH = Na2CO3+2H2O
B.HCl + NH3·H2O = NH4Cl + H2O
C.Fe(OH)3 + 3HCl = FeCl3 + 3H2O
D.H2SO4 + 2KOH = K2SO4 + 2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列物质:①氯气、②铜片、③碳酸钙、④蔗糖、⑤HCl气体、⑥SO2气体、⑦氨水,能导电的是________________,属于电解质的是_________________。(填编号)
(2)节日焰火利用的是_________反应,城市射灯在夜空形成五颜六色的光柱,属于______效应。
(3)在 2Na2O2+2CO2===2Na2CO3+O2反应中,_________是还原剂,_________是氧化剂。若转移3mol电子,则所产生的O2在标准状况下的体积为_________。
(4)①除去铁粉中混用铝粉,选用的试剂为:___________;
②NaHCO3溶液中混有Na2CO3 选用的试剂为________________________;
③除去Na2CO3粉末中的NaHCO3 ,采用的方法___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,欲测定Na2O2试样的纯度。可供选用的反应物只有CaCO3固体、6mol·L-1硫酸、6mol·L-1盐酸和蒸馏水。已知:①浓硫酸有吸水性、脱水性和强氧化性,②碱石灰的成分为CaO和NaOH。实验方案为:①制备并提纯CO2。②将纯净的CO2通过试样。③测定生成O2的体积。④根据O2的体积计算Na2O2试样的纯度。实验装置如下:

回答下列问题:
(1)装置A中发生反应的离子方程式是______________________________________。
(2)装置B的作用是_______________________,装置C的作用是_______。
(3)装置E的作用是__________________________________________
(4)装置D中发生反应的化学方程式是______________________________________。
(5)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com