
科目: 来源: 题型:
【题目】分类是化学学习和研究中的常用手段。下列分类依据和结论都正确的是( )
A. ![]() 、
、![]() 、
、![]() 均可由活泼金属和活泼非金属作用形成,都是离子化合物
均可由活泼金属和活泼非金属作用形成,都是离子化合物
B. ![]() 、
、![]() 、
、![]() 均具有氧化性,都是氧化性酸
均具有氧化性,都是氧化性酸
C. ![]() 、
、![]() 、
、![]() 、
、![]() 熔融状态或溶于水时能导电,都是电解质
熔融状态或溶于水时能导电,都是电解质
D. ![]() 、
、![]() 、
、![]() 中均含有氧,都是氧化物
中均含有氧,都是氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】地壳中铝元素比铜元素含量高很多,但人们冶炼出铜比铝早很多年。合理的解释是( )
A. 铜矿较易还原,铝矿很难还原
B. 铜矿颜色较深,易发现;铝矿颜色较浅,不易发现
C. 矿石在地下埋藏,铜矿最浅,容易开发,铝矿埋得深,难开发
D. 铜比铝的相对原子质量大
查看答案和解析>>
科目: 来源: 题型:
【题目】“铜绿”即是铜锈,它的化学成分是Cu2(OH)2CO3(碱式碳酸铜)。铜在潮湿的空气中生锈的化学反应为2Cu+O2+CO2+H2O====Cu2(OH)2CO3。下列有关该反应的说法正确的是 ( )
A.该反应不是氧化还原反应
B.该反应中氧元素和碳元素化合价发生变化,所以是氧化还原反应
C.该反应中铜得电子,O2失电子,所以是氧化还原反应
D.该反应是氧化还原反应,变价的只有两种元素
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究黄色固体A(仅含三种元素)的组成和性质,设计并完成如下实验:

已知:a.气体C能使品红溶液褪色 b.溶液D遇KSCN溶液显血红色
c.溶液D中加入过量铁粉,充分反应后铁粉质量减少32g
请回答:
(1)A的化学式是_________。
(2)固体A与O2反应生成B和C的化学方程式_________。
(3)少量Mg在气体C中完全燃烧,产生的固体产物中含有单质、氧化物,有人认为还可能存在一种含氧酸盐,请推测该盐的成分,并设计实验方案验证_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
能使化学反应速率加快的措施有________(填序号)。
①增加C的物质的量 ②升高反应温度
③随时吸收CO、H2转化为CH3OH ④密闭定容容器中充入CO(g)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)CO2(g)+H2(g),得到如下两组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 2 | 4 | 0.8 | 3.2 | 3 |
①实验1中以v(CO2)表示的化学反应速率为________。
②该反应的逆反应为________(填“吸”或“放”)热反应。
(3)在一容积为2 L的密闭容器内加入2 mol的CO和6 mol的H2,在一定条件下发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0,该反应的逆反应速率与时间的关系如图所示:
CH3OH(g) ΔH<0,该反应的逆反应速率与时间的关系如图所示:
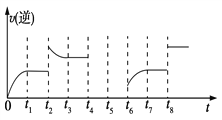
①由图可知反应在t1、t3、t7时都达到了平衡,而在t2、t8时都改变了条件,试判断t8时改变的条件可能是________。
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 镁片插入硝酸银溶液中:Mg+2Ag+=== Mg2++2Ag
B. 常温下将氯气通入水中:Cl2+ H2O![]() H+ + Cl-+ HClO
H+ + Cl-+ HClO
C. 氯气与碘化钾溶液反应:Cl2+I-===2Cl-+I
D. 大理石加到盐酸中反应:CO32-+2H+===CO2↑+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】以烃A为原料在隔绝空气、高温的条件下获得有机物B、C,有机物B、C、D、E、F之间的相互转化关系如下图。已知烃A在标准状况下的密度为l.96g·L-1,C 为天然气的主要成分,F有浓郁香味。
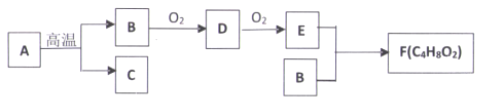
(1)有机物E中含有的官能团名称是_________。
(2)B+ E→F的反应类型是_________。
(3)有机物A在髙温下转化为B和C的化学方程式是_________。
(4)下列说法正确的是_________。
A.有机物A与C为同系物
B.有机物F可以在NaOH溶液中水解,属于皂化反应
C.有机物D可以和氢气发生加成反应
D.有机物A转化成B和C的反应在工业上用于提高汽油产量
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①⑩种元素,填写下列空白:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:________(填元素符号)。元素⑦原子结构示意图为________________ 。元素⑩名称为____________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:____________。
(3)最高价氧化物是两性氧化物的元素是________;写出它的氧化物与氢氧化钠反应的离子方程
式_______________________________________。
(4)③、⑥、⑦三种元素形成的离子,离子的半径由大到小的顺序是_______________。
(5)元素③的氢化物常溫下和元素⑦的单质反应的化学方程式为_______________。
(6)用一个离子方程式证明⑦和⑩的非金属性强弱________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

(1)该反应是_____________(填“吸热”“放热”)反应。
(2)当反应达到平衡时,升高温度,A的转化率_____________ (填“增大”“减小”或“不变”),
(3)反应体系中加入催化剂对反应热是否有影响?_________________________。
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是: E1__________,E2-E1_____________ (填“增大”“减小”或“不变”)。
(5)在火箭推进器中装有肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量的气体,并放
出大量热。己知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量。写出该反应的热化学方程式________________。
(6)N2H4可构成燃料电池,产物为无污染物质,写出在碱性环境下的负极电极反应式________________。
用该电池电解硫酸铜溶液(极棒都是石墨),电池中转移8mol电子,则硫酸铜溶液阳极产生的物质
为_________mol,该极电极反应式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com