
科目: 来源: 题型:
【题目】以下属于新能源的主要包括( )
①核能 ②柴草 ③焦炭 ④太阳能 ⑤氢能 ⑥液化石油气 ⑦水煤气 ⑧天然气
A. ②③⑥⑦ B. ①④⑤ C. ③⑥⑦⑧ D. ①②④
查看答案和解析>>
科目: 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。

请回答:
(1)甲池中正极是_______负极是________负极反应式:________________。
(2)乙池中负极是__________正极是__________,总反应的离子方程_______。
(3)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出___活动性更强,而乙会判断出___活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些正确结论?___(填写字母序号)。
a. 利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序判断原电池中的正负极”,这种做法______(填“可靠”或“不可靠”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】A,B,C,D,E为原子序数依次增大的短周期元素.已知A,B,E3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3.
(1)写出元素的名称:C , D;
(2)写出元素的原子结构图:
A , B , 二者离子半径:(填离子符号).
(3)A,B的最高价氧化物的水化物的碱性>(填化学式,下同)
(4)D,E的气态氢化物的稳定性:> .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知2X2(g)+Y2(g)![]() 2Z(g)△H=-akJ·mol-1(a>0),在一个容积2L的容器中加入2mol X2和1molY2,在500℃时充分反应达平衡后Z的浓度为0.8mol·L-1,放出热量240kJ。
2Z(g)△H=-akJ·mol-1(a>0),在一个容积2L的容器中加入2mol X2和1molY2,在500℃时充分反应达平衡后Z的浓度为0.8mol·L-1,放出热量240kJ。
(1)此反应平衡常数表达式为______;若将温度降低到300℃,则反应平衡常数将_____(填增大、减少或不变)
(2)平衡时Y2的转化率为____________
(3)能说明反应己达平衡状态的是___________________________。
A.浓度c(Z)=2c(Y2) B.容器内压强保持不变
C.v(X2)=2 v(Y2) D.容器内的密度保持不变
(4)若将上述容器体积压缩到原来的一半,相同温度下起始加入2molX2和1mol Y2达到平衡后,Y2的转化率将_________________(填变大、变小或不变)
查看答案和解析>>
科目: 来源: 题型:
【题目】填空
(1)某元素原子的质量数为A,它的阴离子Xn﹣核外有x个电子,w克这种元素的原子核内中子的物质的量为mol
(2)在K2SO4和KCl的混合溶液中,K+的物质的量浓度为1.2mol/L,SO42﹣的物质的量浓度为0.4mol/L,则此溶液中Cl﹣的物质的量浓度为:
(3)写出二氧化氮与水的反应方程式 , 氧化剂与还原剂的物质的量比为 .
(4)从1L1molL﹣1NaCl溶液中取出200mL溶液,取出的溶液中NaCl的物质的量浓度是molL﹣1 , 取出的溶液中NaCl的物质的量是mol,质量是g.
查看答案和解析>>
科目: 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH2 II
CO(g)+H2O(g)ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
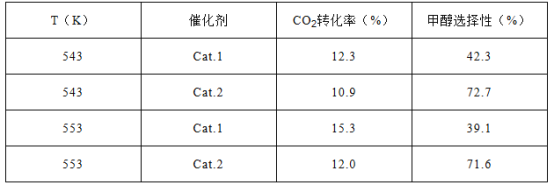
【备注】催化剂.1:Cu/ZnO纳米棒;催化剂.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g)ΔH3=44.0kJ·mol-1
H2O(g)ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=_________;反应II的ΔH2=_____________kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有_________________。
A.使用催化剂.1 B.使用催化剂.2 C.降低反应温度
D.投料比不变,增加反应物的浓度 E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(I)用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
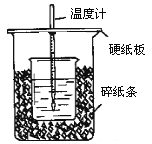
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_________.
(2)烧杯间填满碎纸条的作用是_________________________________.
(3)
依据该学生的实验数据计算,该实验测得的中和热△H=___________;(结果保留一位小数)
(4)_______(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是___________________________ 。
(II)(5)研究浓度对反应速率的影响,用酸性kMnO4和H2C2O4反应,请写出该反应的离子方程式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某100mL混合酸中,HNO3物质的量浓度为0.4mol/L,H2SO4质的量浓度为0.2mol/.向其中加入2.56克Cu粉,待充分反应后,溶液中的Cu2+的物质的量浓度是( )
A.0.15mol/L
B.0.3mol/L
C.0.225mol/L
D.无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com