
科目: 来源: 题型:
【题目】某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,Y的体积分数与时间关系如图II所示.则下列结论正确的是
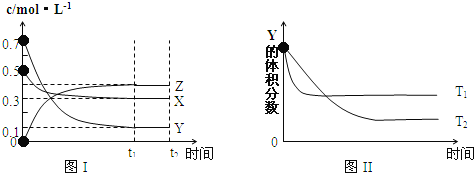
A. 该反应的热化学方程式为:X(g)+3Y(g)![]() 2Z(g);△H>0
2Z(g);△H>0
B. 若其它条件不变,升高温度,正、逆反应速率均增大,X的转化率减小
C. 达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
D. 达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气: 2NO+2CO ![]() 2CO2+N2 .
2CO2+N2 .
(1)写出CO2的结构式 , N2的电子式 .
(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示: 
①则反应速率 ![]() (a)、
(a)、 ![]() (b)、
(b)、 ![]() (c)的大小关系是;
(c)的大小关系是;
②下列可说明反应到达图中c点的是;
A.NO、CO、CO2、N2的浓度比值保持2:2:2:1不变
B.CO的浓度不再改变
C.反应消耗2molNO的同时消耗1molN2
D.容器中的气体质量或物质的量保持不变
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究. 【资料查阅】
A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
实验编号 | 实验目的 | T/℃ | NO初始浓度 | CO初始浓度 | 同种催化剂的比表面积 | 达平衡时所用的时间min |
Ⅰ | 参照实验 | 280 | 6.50×10﹣3 | 4.00×10﹣3 | 80 | t |
Ⅱ | 280 | 6.50×10﹣3 | 4.00×10﹣3 | 120 | 0.5t | |
Ⅲ | 360 | 6.50×10﹣3 | 4.00×10﹣3 | 80 | 0.2t |
【结论】①实验编号Ⅱ的实验目的为 .
②课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是 , 且反应速率将 . (填“增大”、“减小”、“无影响”).
查看答案和解析>>
科目: 来源: 题型:
【题目】碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq)![]() I2-(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是
I2-(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是

A. 上述正反应为放热反应
B. 上述体系中加入苯,平衡不移动
C. 可运用该反应原理除去硫粉中少量的碘单质
D. 实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】根据给定信息书写氧化还原方程式:(9分)
(1)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 。
(2)硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式。
(3)在盛有10mL1.0mol·L-1的碘水的试管中,通入足量Cl2完全反应后,共转移了0.1mol电子。写出该反应的化学方程式: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 植物油的主要成分是高级脂肪酸B. 醋酸铅溶液可使鸡蛋清中的蛋白质变性
C. 蔗糖及其水解产物均可发生银镜反应D. 合成纤维和棉花的主要成分均为纤维素
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下,N2(气)和H2(气)生成2mol NH3(气)放出92.4 kJ热量。现有甲、乙两个容积相同且恒容的密闭容器,在常温下:①向密闭容器甲中通入1 molN2和3 mol H2,达到平衡时放出热量Q1kJ。②向密闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2kJ。则下列关系式正确的是
A. Q1=2Q2=92.4 B. 92.4 >Ql>2Q2 C. 92.4=Q1>2Q2 D. 92.4 >Q1=2Q2
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在固定容积的密闭容器中,可逆反应:mA(g)+nB(g)![]() pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成mmolA同时消耗qmol的D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;⑤反应速率vA:vB:vC:vD=m∶n∶p∶q;⑥各组分的质量分数不再改变;⑦反应混合物的平均摩尔质量不再发生变化,其中一定能说明反应已达到平衡状态的是
pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成mmolA同时消耗qmol的D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;⑤反应速率vA:vB:vC:vD=m∶n∶p∶q;⑥各组分的质量分数不再改变;⑦反应混合物的平均摩尔质量不再发生变化,其中一定能说明反应已达到平衡状态的是
A. ②③④⑥ B. ③⑥⑦ C. ②③⑥ D. ③⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: 
(1)该反应的化学方程式为 .
(2)反应开始至2min,气体Z的反应速率为 .
(3)若X、Y、Z均为气体,反应达到平衡时,压强是开始时的倍;此时放出了a kJ的热量,则按(1)的反应方程式写成热化学反应方程式时,该反应的反应热△H= .
(4)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.已知:
化学键 | H﹣H | H﹣Cl | Cl﹣Cl |
键能/KJmol﹣1 | 436 | 431 | 242 |
工业上通过氢气在氯气中充分燃烧制取HCl气体,写出该反应的热化学反应方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com