
科目: 来源: 题型:
【题目】三氯氧磷(POCl3)广泛用于农药、医药及阻燃剂的生产工业等,工业制备三氯氧磷的过程中会产生副产品亚磷酸(H3PO3)。
(1)三氯氧磷可通过氯化水解法制备,由三氯化磷、水、氯气加热反应生成,则该反应中另一产物的化学式为____________。
(2)已知H3PO3为二元弱酸。某温度下,0.1 mol·L-1的H3PO3溶液中c(H+) = 2.5×10-2 mol·L-1。则该温度下H3PO3的第一步电离的平衡常数Ka1=_______(H3PO3的第二步电离忽略不计,保留两位有效数字)。
(3)亚磷酸具有强还原性,可将Cu2+还原为金属单质,亚磷酸与硫酸铜溶液反应的化学方程式为_____________________。
(4)工业上生产三氯氧磷的同时会产生含磷废水(主要成分为H3PO4、H3PO3)。向废水中先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中 c(PO43-)=4×10-7 mol·L-1,则溶液中c(Ca2+)=___________mol·L-1。{已知Ksp=[Ca3(PO4)2]=2×10-29 }
查看答案和解析>>
科目: 来源: 题型:
【题目】煤燃烧后的主要产物是CO、CO2。
(1)以CO2为原料可制备甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1,向1L的恒容密闭容器中充入1mol CO2(g)和3mol H2(g),测得CO2(g)和CH3OH(g)浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1,向1L的恒容密闭容器中充入1mol CO2(g)和3mol H2(g),测得CO2(g)和CH3OH(g)浓度随时间的变化如图所示。
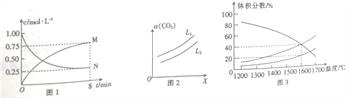
①图1中N表示的是______(填化学式);0~8min内,以氢气表示的平均反应速率v(H2)=_______mol L-1 min-1。
②在一定条件下,体系中CO2的平衡转化率(ɑ)与L和X的关系如图2所示,L和X分别表示温度和压强。X表示的物理量是____________(填“温度”或“压强”),L1________(填“>”或“<”)L2。
(2)向一体积为20L的恒容密闭容器中通入1molCO2发生反应:2CO2(g)![]() 2CO(g)+O2(g),在不同温度下各物质的体积分数变化如图3所示。1600℃时反应达到平衡,则此时反应的平衡常数K_____________。
2CO(g)+O2(g),在不同温度下各物质的体积分数变化如图3所示。1600℃时反应达到平衡,则此时反应的平衡常数K_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应A(g)+4B(g) = 2C(g)+2D(g),下列数据表示反应进行得最快的是( )
A. v(A)=1.4mol/(L·s) B. v(B)=3.6mol/(L·s)
C. v(C)=2mol/(L·s) D. v(D)=3.0mol/(L·min)
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学实验操作考试中,有一题目是鉴别澄清石灰水和氢氧化钠溶液.请你参与探究: [提出问题]如何鉴别这两种无色溶液?
[实验方案]小琪等几位同学进行了如图所示的实验.
请你回答下列问题:
(1)C组实验中反应的化学方程式为;
(2)其中不能达到实验目的是(填字母);
(3)D组实验中变浑浊的原溶液是 . [继续探究]实验结束后,小琪同学将A、B、C、D四组试管中的物质全部倒入同一个干净的烧杯中,充分反应后,得到无色澄清透明的溶液,对该溶液的成分又进行了探究.
[提出问题]该溶液中除水、酚酞外还含有哪些物质?
[查阅资料]氯化钙溶液呈中性.
[猜想与假设]Ⅰ.
Ⅱ.NaCl、CaCl2、HCl
Ⅲ.NaCl、CaCl2、NaOH
[反思与拓展]①上述猜想与假设中只有一个不成立,它是(填序号),理由是 .
②根据所学化学知识,验证烧杯内溶液中可能有的物质是否存在,下列哪些物质单独使用不能完成该实验(填字母)
a.pH试纸 b.硝酸银溶液 c.紫色石蕊试液 d.铜 e.足量氢氧化钠溶液.
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向0.1 mol L-1CH3COOH溶液中不断加水,过程中始终保持增大的是( )
A. c(H+) B. Ka(CH3COOH) C. c(H+)·c(OH-) D. 
查看答案和解析>>
科目: 来源: 题型:
【题目】废旧锂电池正极材料主要含LiCoO2、Al等,以其为原料获得CoC2O4和LiCO3的一种工艺路线如图所示。已知:LiCoO2是不溶于水的固体。

回答下列问题:
(1)滤液①的主要溶质的化学式是_____________。
(2)反应①中过滤时所需的玻璃仪器有___________________。
(3)反应②中LiCoO2与H2O2反应的离子方程式为__________________。
(4)滤液③中含有Na2C2O4,0.1 mol·L-1的Na2C2O4溶液中离子浓度由大到小的顺序是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是一种食品添加剂。实验室用如图所示装置制备Na2S2O5,实验步骤如下:

Ⅰ.向Na2CO3溶液中通入SO2至溶液pH为4.1,生成NaHSO3溶液;
Ⅱ.加入碳酸钠粉末至溶液PH为7~8;
Ⅲ.再通入SO2至溶液PH为4.1;
Ⅳ.从过饱和溶液中析出Na2S2O5晶体。
(1)制备焦亚硫酸钠总反应的化学方程式为___________________ 。
(2)Na2S2O5能与水发生化合反应,反应后所得的溶液显酸性。用电离方程式表示溶液显酸性的原因:____________________。
(3)利用碘量法可测定Na2S2O5产品中硫的含量。实验中必须使用的试剂有c1mol·L-1的标准碘溶液、c2 mol·L-1的标准Na2S2O3溶液、NaOH溶液、淀粉溶液。已知:Na2S2O5+2I2+3H2O=Na2SO4+H2SO4+4HI,2Na2S2O3+I2= Na2S2O6+2NaI。请补全实验方案:将一定量的Na2S2O5产品放入碘量瓶(带磨口塞的锥形瓶)中,加入—定体积的过量c1 mol L-1的标准碘溶液,充分反应后滴入NaOH溶液调节溶液pH至中性,____________________________。重复上述步骤2次,记录数据。
(4)含铬酸性废水中常含有+ 6价铬。利用Na2S2O5和FeSO4·7H2O分两个阶段先后处理含Cr2O72-的废水, Cr2O72-被还原为Cr3+,实验结果如图。

①0~40 min内用Cr2O72-表示的平均反应速率为____________mol L-1 min-1。
②60~80 min内Cr2O72-与Fe2+发生反应的离子方程式为_________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com