
科目: 来源: 题型:
【题目】A为含三种元素的钠盐,其水溶液显碱性.C为大理石的主要成分,请填空: 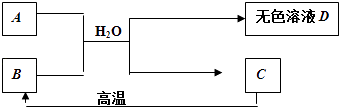
(1)C的化学式 .
(2)D中一定含有的溶质是 . 理由是(用化学方程式表示) .
(3)B用作食品干燥剂的原理: . (用化学方程式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,经测定Fe3+、SO42-、Al3+和M离子的物质的量之比为1:4:1:2,则M离子可能是下列中的( )
A. S2- B. OH- C. Na+ D. Ag+
查看答案和解析>>
科目: 来源: 题型:
【题目】需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别是( )
A. 1000mL,212g B. 950mL,543.4g C. 任意规格,572g D. 1000mL,286g
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,正确的是
A. 水晶和陶瓷的主要成分都属于硅酸盐 B. 单质硅是制造光导纤维的材料
C. 硅酸钠是制备硅胶和木材防火剂的原料 D. 工业上用盐酸刻蚀玻璃
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,几种酸的电离平衡常数如下:
化学式 | HCOOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)上述三种弱酸中,酸性最强的是______________________________(填化学式),其电离方程式为_____________________________________________,电离平衡常数表达式K=_________。
(2)写出H2CO3溶液中存在的各种离子的符号:_________________________________。
(3)向Na2CO3溶液中加入足量HClO,有关反应的离子方程式为____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氯化二硫(S2Cl2,沸点137.1℃)是一种黄红色液体,溶于CCl4、二硫化碳等,遇水分解为硫、二氧化硫、氯化氢,超过100 ℃开始分解,300℃分解完全。可用作橡胶的低温硫化剂和粘结剂。可由二硫化碳(沸点46.5℃)与Cl2在95~100 ℃制备,同时有CC14 (沸点76. 8℃)生成,实验装置如下:

下列说法正确的是
A. ③、⑥中依次盛放浓硫酸、无水CaCl2
B. 实验中需用酒精灯对④进行直接加热
C. 实验过程中⑤冷凝回流的主要物质是S2Cl2
D. 用减压分馏法从④中所得液体分离出S2Cl2
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分:
C | N | |||
X | Y | Z | Cl |
回答下列问题:
(1)Y在元素周期表中的位置为__________,X的简单离子结构示意图为_______________。
(2)表中元素中:原子半径最大的是_________(填元素符号),最高价氧化物对应水化物的酸性最强的是______________(填化学式)。
(3)下列事实能说明氯的非金属性比氮强的事实是________(填字母)。
a.Cl2的沸点比N2的高 b.3Cl2+2NH3=6HCl+N2
c.Cl2中原子间为含单键,N2中原子间为三键 d.HCl和NH3受热分解,HCl分解温度高
(4)碳与X可形成化合物M,M的相对分子质量为144。M与盐酸反应的化学方程式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锰及其化合物在现代工业和国防建设中具有十分重要的地位。金属锰的提炼方式主要有热还原法和电解法两种,热还原法得到的锰纯度在95-98%之间,电解法得到的锰(简称电解锰),其纯度可达99.7-99.9%以上。
(1)锰锌铁氧体是当前广泛使用的一种隐形涂料,其化学组成为MnxZn1-xFe2O4(铁为+3价),其中当锰锌铁氧体中n(Zn):n(Fe)=2:5时,它对雷达波的吸收能力最强。
① 锰锌铁氧体中锰元素的化合价为_______。
② 当雷达波吸收能力最强时,该物质的化学式为________(改写成氧化物的形式)。
(2)写出以MnO2和Al粉为原料,利用热还原法制备Mn的化学方程式:________.
(3)工业上以菱锰矿(主要成分是MnCO3,含有Fe2+、Co2+、Ni2+等杂质金属离子)为原料制备电解锰的流程图如下所示。

生成氢氧化物的pH如下表:
物质 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
开始沉淀时pH | 7.5 | 2.l | 7.7 | 7.6 | 8.3 |
完全沉淀时pH | 9.7 | 3.7 | 8.5 | 8.2 | 9.8 |
① 浸出槽中发生多个反应:如主要成分与硫酸的反应、MnO2与Fe2+间的氧化还原反应等,写出这两个反应的离子方程式:___________________、____________________。
② 加入氨水的目的是为除去杂质,根据流程图及表中数据,pH 应调控在_____范围内。常温下,Ksp[Fe(OH)3]=4.0×10-38,当pH=4时溶液中c(Fe3+)=__________。
③ 加入硫化铵是为除去剩余的Ni2+,反应的离子方程式为____________________。
④ 写出电解硫酸锰溶液制取金属锰的化学方程式:________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与科技、社会、生产密切结合,下列有关说法不正确的是( )。
A.“乙醇汽油”的广泛使用能有效减少有害气体的排放
B.“无磷洗涤剂”的推广使用,能有效减少水体富营养化的发生
C.“无氟冰箱”取代“含氟冰箱”,对人类的保护伞——臭氧层起到保护作用
D.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com