
科目: 来源: 题型:
【题目】用硫及其化合物制硫酸有下列三种反应途径,某些反应条件和产物已省略。下列有关说法不正确的是( )

A. 途径①的反应中体现了浓HNO3的强氧化性
B. 途径②、③的第二步反应在实际生产中可以通过增大O2的浓度来低成本
C. 由途径①、②、③分别制取1molH2SO4,理论上各消耗1molS,各转移6mole-
D. 途径②、③比途径①污染相对小且原子利用率高,更能体现“绿色化学”的理论
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应不属于加成反应的是 ( )
A.乙烯通入溴水后,溴水褪色B.乙烯通入酸性高锰酸钾溶液后,溶液褪色
C.乙烯在一定条件下与H2反应D.乙烯在一定条件下与H2O反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组用浓度为0.20mol·L-1的盐酸标准液滴定含有一定量杂质的烧碱样品(杂质与酸不反应)溶于水形成的溶液。

(1)准确量取一定体积的待测液需要使用的仪器是______________。
(2)若滴定开始和结束时,滴定管中的液面如图所示,则消耗盐酸标准液的体积为________mL。
(3)滴定时,若以酚酞为指示剂,滴定达到终点的标志是______________________________。
(4)将准确称取的5.0g烧碱样品配制成250mL待测液,并用盐酸标准液滴定。滴定前读数及滴定后读数如下表所示。
滴定次数 | 待测液体积(mL) | 0.20mol·L-1的盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.70 | 20. 60 |
第一次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 1.10 | 21.10 |
由实验数据可知,烧碱的纯度为__________。
(5)下列操作会导致测得的待测液的浓度偏大的是________(填字母)。
a.部分标准液滴出锥形瓶外 b.用待测溶液润洗锥形瓶
C.锥形瓶洗净后还留有蒸馏水 d.放出碱液的滴定管开始有气泡,放出液体后气泡消失
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )

选项 | a中物质 | b中物质 | c中收集气体 | d中物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | 浓盐酸 | HCl | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组为比较Al和Fe的金属性强弱,设计了图1所示的装置,甲中锥形瓶内盛放的是100ml稀盐酸(反应前后溶液体积变化可以忽略不计). 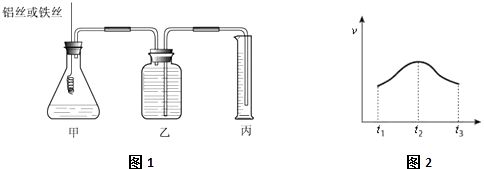
(1)若要比较产生气体的快慢有两种方法,一种是比较产生相同体积气体所需的时间,另一种是比较;
(2)实验测得产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间内速率逐渐加快说明该反应是(填放热或吸热)反应,t2~t3时间内速率逐渐减慢的主要原因是;
(3)如果在相同条件下,把甲锥形瓶内盛放稀盐酸改成H+浓度相同的稀硫酸,发现反应会比原来慢许多,原因可能是;(写出合理的一种即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】理论上讲,任何自发的氧化还原反应都可以设计成原电池.
(1)请利用反应“Cu+2Ag+═2Ag+Cu2+”在右图方框中设计一个化学电池,指明电池的正负极材料及电解质溶液,并标出电子流动的方向. 
(2)该电池的负极反应式为;
(3)若导线上转移电子2.5mol,则正极生成银克.
(4)若原电池的总反应为Cu+2Fe3+═2Fe2++Cu2+ , 则此电池的正极反应式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】向一体积为2L的恒温恒容密闭容器中充入一定量的H2和N2,发生反应:N2(g)+ 3H2(g) ![]() 2NH3(g) △H=a kJmol-1。体系中气体的物质的量随时间的变化如图所示。
2NH3(g) △H=a kJmol-1。体系中气体的物质的量随时间的变化如图所示。
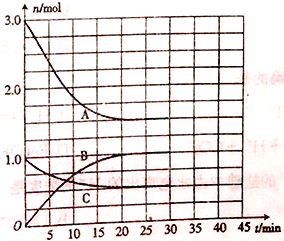
(1)表示N2浓度变化的曲线是________(填“A”“ B”或“C”),25min时,c(NH3)= ______。
(2)0~20min内,v(H2)= ______。若该过程中反应放出的热量为47.2kJ,则a=______。
(3)30min时,向容器中再充入一定量的NH3,一段时间后,与原化学平衡状态时的反应速率相比,正反应速率______(填“增大”“ 减小”或“不变”,下同),逆反应速率_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL 2mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。

当V1=160mL时,则金属粉末中n(Mg)=________ mol,V2=_____________mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH) _____________mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com