
科目: 来源: 题型:
【题目】W,X,Y,Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素且其焰色反应为黄色.Y和W的最外层电子数相等.Y,Z两元素原子的质子数之和为W,X两元素质子数之和的3倍且Z的单质为淡黄色固体.由此可知:
(1)写出元素符号W , Z .
(2)W2X的电子式为 .
(3)由Y,X,W组成的化合物中有键和键.
(4)由W,X,Y,Z四种元素组成的化合物的化学式为 , ;写出这两种物质之间反应的离子方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】图中A,B,C,D是同周期或同主族的相邻元素: ![]()
(1)已知:A元素的最低价为﹣3价,它的最高价氧化物含氧56.34%,原子核内中子数比质子数多1个,则A元素原子的质量数为 .
(2)写出元素符号A , C , D .
(3)A,B,C三种元素最高价氧化物的水化物中酸性最强的是 . (填化学式)
(4)B,D两种元素和氢组成的气态氢化物中稳定性强的是 , 还原性最强的是(填化学式)
查看答案和解析>>
科目: 来源: 题型:
【题目】A,B,C,D四种元素都是短周期元素.A元素的离子具有黄色的焰色反应.B元素的离子结构和Ne具有相同的电子层排布;5.8g B的氢氧化物恰好能与100mL 2mol/L盐酸完全反应;B原子核中质子数和中子数相等.H2在C单质中燃烧产生苍白色火焰.D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍.根据上述条件,回答:
(1)元素C的最高价氧化物的化学式为 .
(2)写出元素名称A , B .
(3)A与D形成稳定的化合物的化学式为 .
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】中国丝绸有五千年的历史和文化。古代染坊常用某种“碱剂”来精炼丝绸,该“碱剂”的主要成分是一种盐,能促进蚕丝表层的丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮。这种“碱剂”主要成分可能是( )
A.氢氧化钾B.次氯酸钙C.烧碱D.碳酸钾
查看答案和解析>>
科目: 来源: 题型:
【题目】利用合成气(主要成分为CO、CO2和H2)通过下列反应合成甲醇。下列说法正确的是( )
反应①:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H1=41kJ·mol–1
CO(g)+H2O(g) △H1=41kJ·mol–1
反应②:CO(g)+2H2(g)![]() CH3OH(g) △H2=–99kJ·mol–1
CH3OH(g) △H2=–99kJ·mol–1
反应③:CO2(g)+3H2(g)![]() CH3OH(g) + H2O(l) △H3
CH3OH(g) + H2O(l) △H3
A. 反应①为放热反应 B. 增大反应①的压强,H2转化率提高
C. △H3=-58kJ·mol–1 D. 反应②使用催化剂,△H2不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验现象的描述中正确的是( )
A. 向碘水中加入四氯化碳振荡,静置,观察到下层溶液呈紫红色
B. 将二氧化碳通入氯化钙溶液中,产生白色沉淀
C. 用激光笔照射置于暗处的硫酸铜溶液,发现溶液中有一条光亮的“通路”
D. 向氨水中滴加三氯化铁溶液中,先有红褐色沉淀生成后红褐色沉淀消失
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是
A. H+ Na+ CO32- Cl- B. Ba2+ Na+ Cl- SO42-
C. K+ H+ SO42- OH- D. Ag+ Al3+ NO3- H+
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中。“硫酸法”生产钛的原料是钛铁矿[主要成分是钛酸亚铁(FeTiO3),含有Fe(Ⅲ)等杂质],同时获得副产品甲的工业生产流程如下:
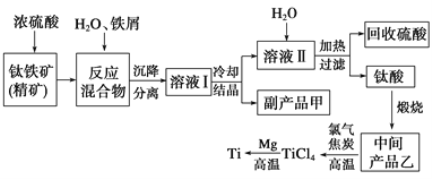
(1)浓硫酸处理钛铁矿时产物之一是TiOSO4,反应中无气体放出,写出该反应的化学方程式___。
(2)上述生产流程中加入铁屑的目的是_______________,可循环利用的物质是_________,检验副产品甲是否变质的实验方法是_________________________________。
(3)溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当pH等于_________时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该沉淀是_______________________________________。
(4)中间产品乙是一种氧化物,其经高温与氯气、焦炭反应,除生成TiCl4外,还生成了一种可燃性气体,请写出该反应的化学方程式___________。
(5)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还原控制的反应条件是__________________________________,反应后的产物需要加入______________溶解后才能达到提纯金属钛的目的。
查看答案和解析>>
科目: 来源: 题型:
【题目】卤代烃能够发生下列反应: 2CH3CH2Br+2Na → CH3CH2CH2CH3+2NaBr。下列有机物可合成环丙烷的是 ( )
A.CH3CH2CH2Cl B.CH3CHBrCH2Br
C.CH2BrCH2CH2Br D.CH3CHBrCH2CH2Br
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com