
科目: 来源: 题型:
【题目】在下列四种溶液中,分别加入少量固体二氧化锰,能产生气体的是( )
A.3%H2O2溶液
B.1 mol/L NaOH 溶液
C.1 mol/L KClO3溶液
D.1 mol/L 盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】苯在催化剂存在下与液溴反应,而苯酚与溴水反应不用加热也不需要催化剂,原因是( )
A.苯环与羟基相互影响,但苯环上的氢原子活泼性不变
B.苯环与羟基相互影响,但羟基上的氢原子变活泼
C.羟基影响了苯环,使苯环上的氢原子变得活泼
D.苯环影响羟基,使羟基变活泼
查看答案和解析>>
科目: 来源: 题型:
【题目】综合题。
(1)反应Fe(s)+CO2(g)FeO(s)+CO(g)△H1 , 平衡常数为K1;反应Fe(s)+H2O(g)FeO(s)+H2(g)△H2 , 平衡常数为K2 . 在不同温度时K1、K2的值如表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应 CO2(g)+H2(g)CO(g)+H2O(g)△H,平衡常数K,则△H=(用△H1和△H2表示),K=(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)CO(g)+H2O(g)是反应(填“吸热”或“放热”).
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为;
②下列措施中能使平衡时 ![]() 增大的是(填序号)
增大的是(填序号)
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是(填字母).
a.容器中压强不变 b.气体的密度不再改变c.v正(CO2)=v逆(CO) d.c(CO2)=c(CO) e.容器内气体总物质的量不变.
查看答案和解析>>
科目: 来源: 题型:
【题目】完成下面各小题:
(1)命名: ![]()
(2)如果(1)中的烷烃是由炔烃与H2加成得到的,则可能的炔烃有种.
(3)若先将CH3CH2CH2Cl与NaOH溶液共热,然后用硝酸酸化,再滴加AgNO3溶液,现象为 , 主要的反应方程式为、 .
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是一个化学过程的示意图. 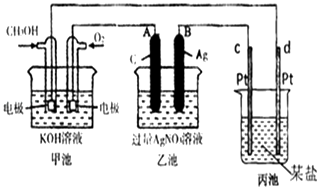
(1)请回答图中甲池是装置,其中OH﹣移向极(填“正”或“负”)
(2)写出通入CH3OH的电极反应式是
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为极(填“A”或“B”),并写出此电极反应的电极反应式 .
(4)乙池中反应的离子方程式为 .
(5)当乙池中B(Ag)极的质量增加2.70g时,乙池的pH是(若此时乙池中溶液的体积为250mL);此时丙池某电极析出0.80g某金属,则丙中的某盐溶液可能是(填序号)
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3 .
查看答案和解析>>
科目: 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.其反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);电解池:2Al+3H2O ![]() Al2O3+3H2↑,电解过程中,以下判断正确的是( )
Al2O3+3H2↑,电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e﹣=Pb2++2H2O | 阳极:2Al+3H2O﹣6e﹣=Al2O3+6H+ |
D |
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目: 来源: 题型:
【题目】利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
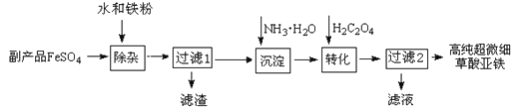
已知:
①过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3
②5Fe2+ +MnO4- +8H+ =5Fe3+ +Mn2+ +4H2O 5C2O42- +2MnO4- +16H+ =10CO2↑+2Mn2+ +8H2O
(1)除杂过程中加入Fe的作用是___________________________。
(2)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有_____。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入30 mL 2mol·L-1 的H2SO4溶解。
步骤2:用c mol·L-1标准KMnO4溶液滴定,消耗其体积a mL。
步骤3:向滴定后的溶液中加入3g Zn粉和8 mL 2mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液b mL。
① KMnO4溶液应该装在_______________滴定管中。
② 用KMnO4溶液滴定待测液,达到滴定终点的标志是__________________________________。
③ 下列操作会导致测定结果中样品的C2O42- 的物质的量偏大的是____________________
A. 步骤2中,滴定管未用标准KMnO4 溶液润洗
B. 步骤3中加入Zn不足
C. 步骤2中,读标准溶液体积时,先仰视后俯视
D. 步骤4中,读标准溶液体积时,先俯视后仰视
④ 样品中C2O42- 的物质的量为_______________________。
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+ 的浓度随反应时间t的变化如下图,其变化趋势的原因可能为__________________________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( ) 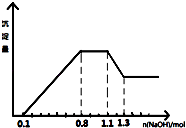
A.溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+
B.溶液中一定不含CO32﹣和NO3﹣ , 一定含有SO42﹣
C.溶液中c(NH4+)=0.3 mol/L
D.c(H+):c(Al3+):c(Mg2+)=1:1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】等体积的AlCl3和NaOH两种溶液混合后,沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则AlCl3和NaOH两种溶液物质的量浓度之比是( ) ①1:3 ②2:3 ③1:4 ④2:7.
A.①②
B.①③
C.②④
D.③④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写及解释均正确的是
A. 0.1mol/L 的 Na2S溶液中 c(S2-)<0.1mol/L 的原因:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
B. 实验室制备氢氧化铁胶体:Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
C. 水中加入NaOH:H2O+H2O![]() H3O++OH-加入NaOH,消耗溶液中的H3O+平衡右移
H3O++OH-加入NaOH,消耗溶液中的H3O+平衡右移
D. 在碳酸钠溶液中通入CO2气体,CO32-+H2O![]() HCO3-+OH-,CO2 消耗OH- 促使平衡正向移动
HCO3-+OH-,CO2 消耗OH- 促使平衡正向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com