
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.有机合成的思路就是通过有机反应构建目标化合物的分子碳架,并引入或转化成所需的官能团
B.有机合成过程可以简单表示为基础原料→中间体Ⅰ→中间体Ⅱ→目标化合物
C.逆合成分析法可以简单表示为目标化合物→中间体Ⅱ→中间体Ⅰ→基础原料
D.为减少污染,有机合成不能使用辅助原料,不能有副产物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是( )
A. SO2具有氧化性,可用于漂白纸浆
B. 明矾易溶于水,可用作净水剂
C. 浓硫酸具有脱水性,可用于干燥氢气
D. MgO、Al2O3熔点高,可用于制作耐火材料
查看答案和解析>>
科目: 来源: 题型:
【题目】硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用.
(1)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJmol﹣1
BaS(s)=Ba(s)+S(s)△H=+460kJmol﹣1
已知:2C(s)+O2(g)=2CO(g)△H=﹣221kJmol﹣1则Ba(s)+S(s)+2O2(g)=BaSO4(s)△H= .
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HNO3有如下反应:As2S3+10H++10NO3﹣=2H3AsO4+3S+10NO2↑+2H2O,当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为 .
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中主要含硫各物种(H2S、HS﹣、S2﹣)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图1所示(忽略滴加过程H2S气体的逸出).①含硫物种B表示 . 在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为(填字母).
a.c(Na+)=c(H2S)+c(HS﹣)+2c(S2﹣)
b.2c(Na+)=c(H2S)+c(HS﹣)+c(S2﹣)
c.c(Na+)=3[c(H2S)+c(HS﹣)+c(S2﹣)]
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是(用离子方程式表示).
(4)硫的有机物( ![]() )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O.
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O. ![]() 及X的核磁共振氢谱如图2,其中(填“Ⅰ”或“Ⅱ”)为
及X的核磁共振氢谱如图2,其中(填“Ⅰ”或“Ⅱ”)为 ![]() 的核磁共振氢谱图.写出X的结构简式: .
的核磁共振氢谱图.写出X的结构简式: . 
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算),现提供的试剂有:a.甲酸钠,b.5molL﹣1硝酸,c.5molL﹣1盐酸,d.5molL﹣1硫酸,e.3%H2O2溶液,f.澄清石灰水.
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
请补充完整由碳酸钙制备甲酸钙的实验步骤
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2. .
步骤3. .
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经、、洗涤干燥得甲酸钙晶体.
查看答案和解析>>
科目: 来源: 题型:
【题目】元素R,X,T,Z,Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( ) 
A.非金属性:Z<T<X
B.R与Q原子核外电子数相差26
C.气态氢化物稳定性:R<T<Q
D.最高价氧化物的水化物的酸性:X>T
查看答案和解析>>
科目: 来源: 题型:
【题目】由以下一些微粒: ![]() C、
C、 ![]() K、
K、 ![]() Ca、
Ca、 ![]() C、
C、 ![]() N、
N、 ![]() Ar其中:
Ar其中:
(1)互为同位素的是和;
(2)质量数相等,但不能互称同位素的是和;
(3)中子数相等,但质子数不相等的是和、和 .
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空
(1)有如图所示A、B、C、D四种仪器:请将仪器A和D的名称填入相应的空格内: 
A. , D. ;使用前需要检查是否漏水的是(选填A、B、C、D).
(2)实验室中由粗盐结晶制精盐的操作包括溶解、过滤、蒸发等步骤. ①过滤的目的是 .
A.获得NaCl晶体 B.除去难溶性物质
C.除去易挥发物质 D.除去可溶性物质
②过滤需要用到的玻璃仪器有烧杯、玻璃棒和(选填A、B、C、D).
查看答案和解析>>
科目: 来源: 题型:
【题目】化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是( ) 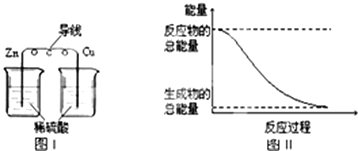
A.化学反应中能量变化的主要原因是化学键的断裂与生成
B.铝热反应中,反应物的总能量比生成物的总能量低
C.图I所示的装置能将化学能转变为电能
D.图II所示的反应为吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.实验室制取时,将工业用氢氧化钙(含铜离子等杂质)和甲醛依次加入到质量分数为30﹣70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是 .
(2)反应温度最好控制在30﹣70℃之间,温度不易过高,其主要原因是 .
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是 .
(4)实验时需强力搅拌45min,其目的是;结束后需调节溶液的pH 7~8,其目的是 . 最后经结晶分离、干燥得产品.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com