
科目: 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为ρ g/ml,质量分数为w,物质浓度为cmol/L,则下列关系中不正确的是( )
A.ρ= ![]()
B.W= ![]()
C.W= ![]()
D.C= ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】工业废气中氮氧化物是主要污染物,为了治理污染,常通入NH3 , 发生反应NOx+NH3→N2+H2O来治理污染.现有NO,NO2的混合气体3L,用同温同压下3.5LNH3使其恰好完全转化为N2 , 则混合气体中NO、NO2的物质的量之比为( )
A.1:1
B.2:1
C.1:3
D.1:4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验和分析正确的是( )
A.无色溶液中加入AgNO3溶液得白色沉淀,加稀盐酸不消失,可能存在Cl﹣或SO ![]()
B.无色溶液中滴加BaCl2溶液得白色沉淀,加稀硝酸不溶解,则一定含有SO ![]()
C.用CCl4萃取碘水中的碘,下层呈紫红色
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】将过量的BaCl2溶液加入到250ml碳酸钠和硫酸钠的混合溶液中,充分反应后,过滤、洗涤、干燥后得到6.27g沉淀.向沉淀中加入过量的盐酸产生气体,最后有2.33g沉淀不溶.
(1)求此硫酸钠溶液的物质的量浓度.
(2)向沉淀中加入过量的盐酸充分反应,求最终产生的气体在标准状况下的体积.
查看答案和解析>>
科目: 来源: 题型:
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义.
(1)SO2的大量排放会引起严重的环境问题是 , 潮湿条件下,写出大气中SO2转化为HSO3﹣的方程式 .
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣ , 两步反应的能量变化示意图1如下:
1mol H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为
(3)SO2是工业制硫酸的原料气体之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2 , 发生反应:2SO2(g)+O2(g)2SO3(g),过程中测定的部分数据见表:
时间/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.050 |
4 | 0.050 | 0.025 |
5 | 0.040 | |
8 | 0.020 |
①反应在0~4min内的平均速率为v(SO2)=;
②此温度下该反应的化学平衡常数K= ,
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),重新达到平衡时混合气体中SO2的百分含量将(填“减小”,“增大”或“不变”).(4)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有 .
②一般来说,如果一个反应的平衡常数大于105 , 通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10﹣5 , 则认为这个反应很难进行.已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10﹣36;H2S:K a1=1.3×10﹣7 , K a2=7.1×10﹣15 ,
通过计算说明反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq)进行的程度 . 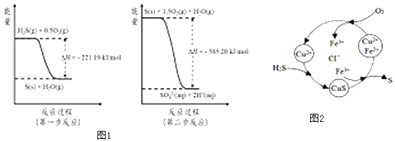
查看答案和解析>>
科目: 来源: 题型:
【题目】近期,世界范围内有成千上万个湖泊变为鱼类绝迹的死湖,数以千万公顷计的森林衰败枯萎,大片土地沙漠化…将这些现象与频繁降落的酸雨相联系,人们认为,酸雨是肇事主因.某研究小组研究某地硫酸酸雨的形成,有人提出以下猜想: 猜想一:SO2 ![]() SO3
SO3 ![]()
![]()
猜想二:S02 ![]()
![]()
![]()
![]()
猜想三:以上两过程同时存在
有关上述猜想,收集一定量该地区刚下的雨水进行实验,下列判断中错误的是( )
A.若猜想一或猜想三正确,则该雨水加入盐酸后,再加入BaCl2溶液,有白色沉淀生成
B.若存在猜想二的过程,则该雨水可能使品红褪色
C.若只存在猜想一的过程,则该雨水的pH随时间延长而增大
D.上述任意一个猜想正确,该地区雨水的pH均小于5.6
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于苯的叙述正确的是( ) 
A.反应①为取代反应,有机产物与水混合浮在上层
B.反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C.反应③为取代反应,有机产物是一种烃
D.反应④中1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上产生的氮氧化物可用天然气来处理.
(1)Ⅰ.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1
N2(g)+2O2(g)=2NO2(g)△H2
H2O(l)=H2O(g)△H3
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△ H=(用△ H1、△ H2、△ H3)
(2)Ⅱ.在温度为T1℃和T2℃时,分别将0.50molCH4和1.2molNO2充入体积固定的2L密闭容器中,发生上述可逆反应,测得不同时刻的n(CH4)数据如下表:
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1℃ | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2℃ | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 | 0.15 |
①分析上表中数据,下列说法正确的是
A.T1℃ 前10min,V(NO2)=0.03mol/(Lmin)
B.T1℃ 反应达化学平衡状态时,CH4的转化率为80%
C.T2℃ 反应在40min时处于平衡状态
D.T1>T2
②反应的平衡常数K(T1) K(T2),△H0,理由是 .
③T1℃时反应的平衡常数K为 .
④反应在T1℃下进行,50min时,向平衡后的容器中再通入0.10molCH4和0.40molNO2 , 在下图中画出恒温,重新达到平衡过程中n(CH4)随时间变化的曲线(只要求画出n(CH4)的变化趋势,不需要准确画出再次平衡后n(CH4) .
(3)Ⅲ.NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图.该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为 . 
查看答案和解析>>
科目: 来源: 题型:
【题目】下列检验试样中某离子的操作及结论不合理的是( )
A.先加HCl无明显现象,再加BaCl2有白色沉淀,一定有SO ![]()
B.加入稀盐酸产生能使澄清石灰水变浑浊的无味气体,则溶液中一定有CO ![]()
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH ![]()
D.做焰色反应,末观察到焰色为紫色,则待测液中一定不含有钾元素
查看答案和解析>>
科目: 来源: 题型:
【题目】用0.1032molL﹣1 HCl溶液滴定未知浓度的NaOH溶液,
(1)某同学按下列步骤进行实验:①取一锥形瓶,用待测NaOH溶液润洗两次; ②在锥形瓶中加入25.00 mL待测NaOH溶液;③加入几滴石蕊试剂做指示剂;④取一支酸式滴定管,洗涤干净; ⑤直接往酸式滴定管中注入标准酸溶液,进行滴定; ⑥两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点. 其中所述操作有错误的序号为
(2)取用25.00 mL待测NaOH溶液应用以下(选填:“甲”、“乙”)装置,若取用NaOH溶液开始平视读数、结束时俯视读数,会导致所测氢氧化钠溶液浓度(填“偏大““偏小“或“不变“) ![]()
(3)若滴定开始前滴定管尖嘴中有一气泡,滴定结束后气泡消失, 则会导致所测氢氧化钠溶液浓度(填“偏大““偏小“或“不变“)
(4)若平行实验三次,记录的数据如下表
滴定次数 | 待测溶液的体积(/mL) | 标准HCl溶液的体积 | |
滴定前读数(/mL) | 滴定后读数(/mL) | ||
1 | 25.00 | 1.02 | 21.04 |
2 | 25.00 | 2.00 | 22.98 |
3 | 25.00 | 0.20 | 20.18 |
试计算待测NaOH溶液的物质的量浓度(列出计算过程).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com