
科目: 来源: 题型:
【题目】已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH ![]() 、Ba2+、Na+、H+、SO
、Ba2+、Na+、H+、SO ![]() 、NO
、NO ![]() 、OH﹣、HCO
、OH﹣、HCO ![]() .将这四种溶液分别标记为A、B、C、D,进行如下实验: ①C溶液滴入另外三种溶液中,均无明显现象;
.将这四种溶液分别标记为A、B、C、D,进行如下实验: ①C溶液滴入另外三种溶液中,均无明显现象;
②D和B反应生成的气体能被A吸收;
③A和D反应生成的气体能被B吸收.
试回答下列问题:
(1)D的化学式是 , 判断理由是 .
(2)写出其余几种物质的化学式:A , B , C .
(3)写出实验②中有关反应的离子方程式 .
(4)写出实验③中有关反应的离子方程式: .
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下: 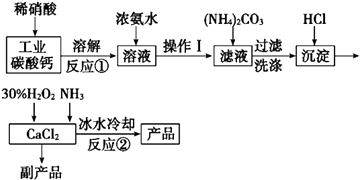
已知:CaO28H2O呈白色微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全.
(1)写出反应①中氧化还原反应的离子方程式: .
(2)向反应①后的溶液中加浓氨水的目的是: , (用方程式表示)
(3)反应②常用冰水控制温度在0℃左右,其可能原因是(写出两种):①;② .
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c molL﹣1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.已知:I2+2S2O32﹣═2I﹣+S4O62﹣ .
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能(填“不受影响”“偏低”或“偏高”),原因是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物的蒸汽完全燃烧时需三倍于其体积的氧气,产生二倍于其体积的二氧化碳该有机物可能是( )
A.C2H6
B.C2H5OH
C.C2H4O
D.C2H4O2
查看答案和解析>>
科目: 来源: 题型:
【题目】根据所学知识完成题目:
(1)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(2)钙元素是人体必需的常量元素,所有的细胞都需要钙元素.测定人体血液中钙元素的含量常用到如下两个反应:①CaC2O4+H2SO4=H2C204+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂mol,有mol电子发生转移,相当于测出含钙元素的质量是g.
查看答案和解析>>
科目: 来源: 题型:
【题目】雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 .
(2)上述反应中的还原剂是 , 反应产生的气体可用吸收,吸收过程中发生的反应的离子方程式为 .
(3)As2S3和浓HNO3反应生成H3AsO4、S和NO2 , 写出该反应的化学方程式并用单线桥法表示电子转移的方向和数目:;
(4)若其氧化产物的总物质的量比还原产物的总物质的量少0.8mol,则反应中转移电子的物质的量为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列方程式书写不正确的是( )
A.在空气中加热钠:2Na+O2 ![]() Na2O2
Na2O2
B.向FeCl3溶液中滴加淀粉碘化钾溶液:2Fe3++2I﹣═2Fe2++I2
C.铁与水蒸气反应:2Fe+3H2O(g) ![]() Fe2O3+3H2
Fe2O3+3H2
D.硅酸钠溶液中滴入稀盐酸:Na2SiO3+2HCl═H2SiO3(胶体)+2NaCl
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是实验室制取少量固体氧化铜的实验,根据实验步骤,回答有关问题.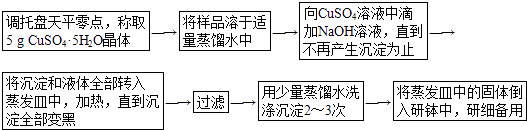
(1)调整天平零点时,若指针偏向右边,应将左边的螺丝(填“向左”或“向右”)旋动.
(2)溶解样品时要用到玻璃棒,其作用是 .
(3)反应生成沉淀的离子方程式为 .
(4)加热蒸发过程中要用到玻璃棒,其作用是 .
(5)过滤中要用到玻璃棒,其作用是 .
(6)洗涤沉淀的目的是;洗涤沉淀的方法是;为了检验沉淀是否洗涤干净,应在最后一次的洗涤液中加入溶液.
(7)若向CuSO4溶液中滴加了 100mL NaOH溶液,则NaOH溶液的物质的量浓度至少为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:CH3COOH═CH3COO﹣+H+达到电离平衡时,电离平衡常数可以表示为Ka= ![]() ;CH3COO﹣+H2O═CH3COOH+OH﹣达到水解平衡时,水解平衡常数可以表示为Kh=
;CH3COO﹣+H2O═CH3COOH+OH﹣达到水解平衡时,水解平衡常数可以表示为Kh= ![]() ,(式中各粒子浓度均为平衡时浓度).
,(式中各粒子浓度均为平衡时浓度).
(1)对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解常数Kh以及水的离子积常数Kw的关系是 , 由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度 . 如在25℃ 时碳酸的K1草酸的K1(填“大于”、“等于”或“小于”),所以,在相同条件下,碳酸氢钠的溶液显性,而草酸氢钠溶液显酸性.
(2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c molL﹣1的CH3COOH溶液中c(H+)=(不为0).
(3)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;
②;
③用(填一种实验方法)测定溶液浓度c′.
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合溶液中所含离子的浓度如下表,则X离子可能为
所含离子 | NO3— | SO42— | H+ | X |
浓度mol/L | 2 | 1 | 2 | 1 |
A.Cl—B.Ba2+C.Fe2+D.Mg2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com