
科目: 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题. 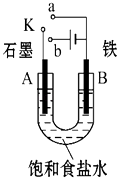
(1)若开始时开关K与a连接,则B极的电极反应式为 .
(2)若开始时开关K与b连接,则B极的电极反应式为 , 总反应的离子方程式为 .
(3)若开关K与b连接,下列说法正确的是(填序号) .
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子
(4)如果模拟工业上离子交换膜法制烧碱的方法,将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示套实验装置,分别回答下列问题: 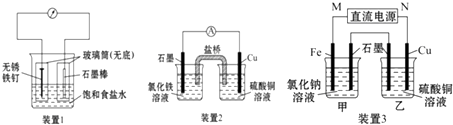
(1)装置1为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入KSCN溶液呈无色,再滴入氯水即可观察到铁钉附近的溶液变红色,表明铁被;向插入碳棒的玻璃筒内滴入酚酞试液,可观察到碳棒附近的溶液变红,该电极反应为 .
(2)装置2中的石墨是极(填“正”或“负”),该装置发生的总反应的离子方程式为 .
(3)装置3中甲烧杯盛放100mL 0.2molL﹣1的NaCl溶液,乙烧杯盛放100mL 0.5molL﹣1的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红.
①电源的M端为极,甲烧杯中铁电极的电极反应为;
②乙烧杯中电解反应的离子方程式为;
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64g,则甲烧杯中产生的气体在标准状况下为mL.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于硅酸盐的叙述中,正确的是 ( )
①硅酸盐大多都难溶于水 ②硅酸盐是构成地壳岩石的最主要成分
③硅酸盐中最常见的是Na2SiO3,它的水溶液俗称水玻璃
A. ③ B. ②③ C. ①② D. ①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常采用煅烧黄铁矿来制备SO2 , 同时产生烧渣.烧渣的主要成分是含铁的氧化物和二氧化硅等,利用烧渣制备高效净水剂聚合硫酸铁可以达到资源综合利用的目的.其工艺流程如图: 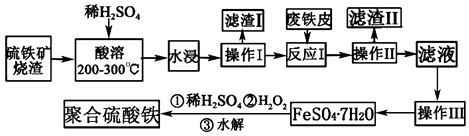
(1)检验“反应I”后的溶液中是否含有Fe3+的试剂是 .
(2)滤渣I的主要成分是 .
(3)“操作III”中具体的方法依次为、、过滤和洗涤.
(4)加入适量H2O2的目的是将Fe2+氧化为Fe3+ , 氧化时需控制反应温度为50~60℃的原因是 ,
(5)生成聚合硫酸铁的过程是先水解再聚合,聚合的化学方程式为mFe2(OH)n(SO4) ![]() [Fe2(OH)n(SO4)
[Fe2(OH)n(SO4) ![]() ]m请写出水解的化学方程式
]m请写出水解的化学方程式
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题意填空
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是: .
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物. 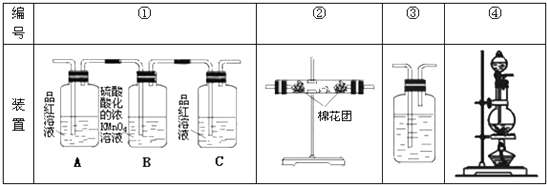
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号):→→→
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色.A瓶溶液的作用是 , B瓶溶液的作用是 , C瓶溶液的作用是 .
(4)装置②中所加固体药品是 , 可验证的产物是 , 确定装置②在整套装置中位置的理由是 .
(5)装置③中所盛溶液是 , 可验证的产物是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用.
(1)已知:①CH4(g)+H2O(g)CO(g)+3H2(g)△H1=+206.1kJmol﹣1
②2H2(g)+CO(g)CH3OH(l)△H2=﹣128.3kJmol﹣1
③2H2(g)+O2(g)2H2O (g)△H3=﹣483.6kJmol﹣1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为 .
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa).
实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/molL﹣1 | H2O初始浓度/molL﹣1 |
1 | 400 | p | 3.0 | 7.0 |
2 | t | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
①实验2和实验3相比,其平衡常数关系是K2K3(填“>”、“<”或“=”).
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为 .
(3)科学家提出由CO2制 取 C的太阳能工艺如图1所示.
①“重整系统”发生的反应中n(FeO):n(CO2)=6:1,则Fe xOy的化学式为 .
②“热分解系统”中每分解l mol Fe xOy , 转移电子的物质的量为 . 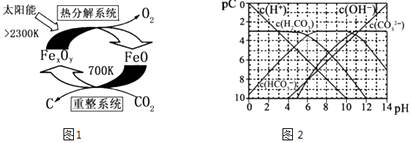
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值.若某溶液中溶质的浓度为1×10﹣3molL﹣1 , 则该溶液中溶质的pC=﹣lg(1×10﹣3)=3.如图2为25℃时H2CO3溶液的pC﹣pH图.请回答下列问题 (若离子浓度小于10﹣5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3﹣、CO32﹣(填“能”或“不能”)大量共存.
②求H2CO3一级电离平衡常数的数值Ka1= .
③人体血液里主要通过碳酸氢盐缓冲体系 ![]() 可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的
可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的 ![]() 最终将 .
最终将 .
A.变大B.变小C.基本不变D.无法判断.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列操作中,完全正确的一组是( )
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过 ![]() 容积的试管加热
容积的试管加热
③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤取用放在细口瓶中的液体时,取下瓶塞倒放在桌面上,倾倒液体时,瓶上的标签对着地面
⑥将烧瓶放在桌上,用力塞紧塞子
⑦用坩埚钳夹取加热后的蒸发皿
⑧将滴管垂直伸进试管内滴加液体
⑨稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中
⑩检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热.
A.①④⑦⑩
B.①③④⑤⑦⑩
C.①④⑤⑦⑧⑨⑩
D.②③④⑤⑥⑦⑩
查看答案和解析>>
科目: 来源: 题型:
【题目】用CO通过下列方法可以合成甲醇。
①CO2(g)+2H2O(l) === CH3OH(g)+ ![]() O2(g) ΔH1=+764.5 kJ·mol-1
O2(g) ΔH1=+764.5 kJ·mol-1
②CO(g)+ ![]() O2(g)===CO2(g) ΔH2=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH2=-283.0 kJ·mol-1
③H2(g)+ ![]() O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
下列有关说法正确的是( )
A.反应①使用催化剂可以提高甲醇产率
B.反应②在任何条件下均能自发进行
C.反应③在100℃时ΔH<-285.8 kJ·mol-1
D.反应CO(g)+2H2(g) ![]() CH3OH(g)的ΔH=-90.1 kJ·mol-1
CH3OH(g)的ΔH=-90.1 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】蚂蚁分泌的蚁酸主要成分是甲酸(结构式为 ![]() ,Ka=1.8×10﹣4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
,Ka=1.8×10﹣4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
(1)该组同学选择如图1所示的装置探究HCOOH在浓硫酸作用下分解产生了CO,请完成下列各小题. 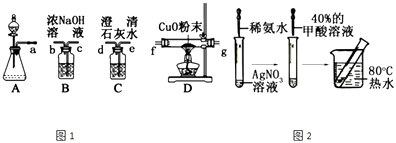
(i)写出甲酸分解的化学方程式;
(ii)装置的连接顺序a;
(iii)HCOOH的分解产物中有CO的现象;
(iv)该实验设计有一处明显的缺陷是;
(2)该组同学分析了甲酸分子结构后,认为甲酸能发生银镜反应,并设计了如图2所示的实验.
(i)依图所示的实验,加热20分钟后并没有出现光亮的银镜.请解释实验中没有产生银镜的原因;
(ii)请设计实验来验证你的解释 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com