
科目: 来源: 题型:
【题目】在下列物质转化中,A是一种酸式盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系:A ![]() B
B ![]() C
C ![]() D
D ![]() E 当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素.请回答:
E 当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素.请回答:
(1)A是 , Z是 .
(2)当X是强酸时,写出B生成C的化学方程式: .
(3)当X是强碱时,E是 , 写出E和铜反应生成C的化学方程式: .
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2SO3的氧化反应:2Na2SO3(aq)+O2(aq)=2Na2SO4(aq)△H=m kJmol﹣1 . 其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段.
(1)已知O2(g)O2(aq)△H=nkJmol﹣1 , Na2SO3溶液与O2(g)反应的热化学方程式为
(2)291.5K时,1.0L溶液中Na2SO3初始量分别为4、6、8、12mmol,溶解氧浓度初始值为9.60mgL﹣1 , 每5s记录溶解氧浓度,实验结果如图.当Na2SO3的初始量为12mmol,经过20s溶解氧浓度降为6.40mgL﹣1 , 则0﹣20s内Na2SO3的平均反应速率为molL﹣1s﹣1
(3)为确定贫氧区速率方程v=kca(SO32﹣)cb(O2)中a,b的值(取整数),分析实验数据.
c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
v×106 | 10.2 | 24.4 | 44.7 | 103.6 |
①当溶解氧浓度为4.0mgL﹣1时,c(Na2SO3)与速率数值关系如表,则a=
②当溶解氧浓度小于4.0mgL﹣1时,图中曲线皆为直线,则b= ,
(4)两个阶段不同温度的速率常数(k)之比如表.
反应阶段 | 速率方程 |
|
富氧区 | v=kc(SO32﹣)c(O2) | 1.47 |
贫氧区 | v=kca(SO32﹣)cb(O2) | 2.59 |
已知ln ![]() =﹣
=﹣ ![]() (
( ![]() ),R为常数,Ea(富氧区)Ea(贫氧区)(填“>”或“<”).
),R为常数,Ea(富氧区)Ea(贫氧区)(填“>”或“<”).
(5)结合图表分析,Na2SO3初始量不同时,划分富氧区与贫氧区的溶解氧浓度是否相同,为什么?.
(6)一定温度下,化学反应速率仅与决速步的反应物浓度有关.Na2SO3氧化反应历程涉及的
①SO32﹣+O2→SO5﹣
②SO5﹣+SO32﹣→SO52﹣+SO3﹣
③SO32﹣+SO32﹣→SO3﹣+SO32﹣
④SO32﹣+O2→SO5﹣
⑤SO52﹣+SO32﹣→2SO42﹣
富氧区与和贫氧区的决速步分别是、(填序号)
查看答案和解析>>
科目: 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测.
(1)冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
已知:I.As2 S3与过量的S2一存在以下反应:As2S3+3S2﹣2AsS ![]()
II.亚砷酸盐的溶解性大于相应砷酸盐
①亚砷酸中砷元素的化合价为 .
②砷酸的电离方程式为 .
③“一级沉砷”中FeSO4的作用是 .
④“二级沉砷”中H2 O2与含砷物质反应的化学方程式为 .
⑤沉淀X为(填化学式).
(2)冶炼废渣中的砷元素主要以As203的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0x 10 ﹣6g).
步骤1:取10g废渣样品,粉碎后与锌粉混合,加人H2 SO4共热,生成AsH3气体.
步骤2:将AsH3气体通人AgNO3溶液中,生成银镜和As2 O3 .
步骤3:取1g废渣样品,重复上述实验,未见银镜生成.
①AsH3的电子式为 .
②步骤2的离子方程式为 .
③固体废弃物的排放标准中,砷元素不得高于4.0×10一5gkg一1 , 请通过计算说明该废渣是否符合排放标准 .
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以绿矾(FeSO47H2O)为铁源制备补铁剂甘氨酸亚铁[(NH2 CH2COO)2 Fe〕.有关物质性质:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇、两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
I.制备FeCO3:将0.10mol绿矾溶于水中,加入少量铁粉,边搅拌边缓慢加入1.1molL﹣1NH4HCO3溶液200mL.反应结束后过滤并洗涤沉淀.
II.制备(NH2 CH2 COO) 2Fe:实验装置如图(夹持和加热仪器已省略),利用A中反应将C中空气排净,再将上述沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,滴入柠檬酸并加热.反应结束后过滤,滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品.
回答下列问题:
(1)实验I中:铁粉的作用是;生成沉淀的离子方程式为 .
(2)实验II中:
①装置B中试剂为 .
②当C中空气排净后,应停止滴加盐酸,打开止水夹 , 关闭止水夹
③装置D中Ca(OH)2的作用是 .
④柠檬酸可调节pH,体系pH与产率的关系如表:
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 5686. |
pH过低使产率下降的原因是;柠檬酸的作用还有(填序号).
a.作反应终点指示剂 b.防止二价铁被氧化 c.促进FeCO3溶解 d.作催化剂
⑤乙醇的作用是 .
⑥若产品的质量为m g,则产率为
(3)设计实验方案测定产品中二价铁含量(不必描述操作过程的细节): .
(已知产品中存在少量三价铁,且仅二价铁可以在酸性条件下被KMnO4、NaC1O或H2 O2定量快速氧化.)
查看答案和解析>>
科目: 来源: 题型:
【题目】塑化剂(DBP)合成线路如图I: 
已知:
a.R1CHO+R2CH2CHO ![]()
![]() +H2O(R1、R2示氢原子或烃基)
+H2O(R1、R2示氢原子或烃基)
b.有机物C为含两个碳原子的烃的含氧衍生物,核磁共振氢谱图如图II.
回答下列问题:
(1)E含有的官能团是 .
(2)E→F的反应类型为
(3)符合图I转化的A的结构有种(不含立体异构).
(4)写出下列化学方程式:
①E和H2以物质的量1:1反应生成F .
②B和F以物质的量1:2合成DBP .
(5)B的同分异构体中能同时符合下列条件的有种(不含立体异构),写出其中任意两种同分异构体(填结构简式).
①不能和NaHCO3溶液反应 ②能发生银镜反应
③遇FeC13溶液显紫色 ④核磁共振氢谱显示苯环上只有一种氢原子
写出B与其中任意一种物质生成的高聚物(填结构简式).
(6)参照上述DBP合成路线,设计以苯甲醛和乙醇为起始原料制备肉桂酸( 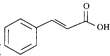 ) 的合成路线 .
) 的合成路线 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是( )
A.NH4HCO3受热易分解,可用作化肥
B.NaHCO3溶液显碱性,可用于制胃酸中和剂
C.SO2具有氧化性,可用于纸浆漂白
D.Al2O3具有两性,可用于电解冶炼铝
查看答案和解析>>
科目: 来源: 题型:
【题目】铜锌原电池(如图)工作时,回答下列问题: 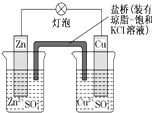
(1)(选填“Zn”或“Cu”)为原电池负极.
(2)在外电路中,电子从(选填“Zn”或“Cu”,下同)极流向极.
(3)正极反应式为
(4)电池反应的离子方程式为
(5)盐桥中的K+移向(选填“ZnSO4”或“CuSO4”)溶液.
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别.线路①、②、③是工业生产硝酸的主要途径,线路Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径.
(1)写出①步反应的化学方程式: .
(2)下列环境问题与NO2的排放有关的是(填字母序号).
A.赤潮
B.光化学烟雾
C.臭氧空洞
D.温室效应
E.酸雨
(3)若将12.8g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6L(标准状况),则所消耗的硝酸的物质的量是 . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com