
科目: 来源: 题型:
【题目】乙醇在生活中用途较多,下列关于乙醇的说法正确的是
A. 能与Na反应
B. 是食醋的主要成分
C. 能使红色石蕊试纸变蓝
D. 能与饱和Na2CO3溶液反应产生H2
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组为了探究一种抗酸药X(仅含五种短周期元素)的组成和性质,设计并完成了如下实验:请回答下列问题: 
(1)白色沉淀B中金属元素的离子结构示意图为 , A的电子式为 .
(2)步骤3中生成沉淀C的离子方程式为 .
(3)X的化学式为 , 该抗酸药不适合胃溃疡重症患者使用,原因是 .
(4)设计实验方案验证步骤3后得到的无色溶液中的含碳离子 .
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列溶液中各组离子一定大量共存的是( )
A.使甲基橙呈红色的溶液中:Na+、AlO2﹣、NO3﹣、CO32﹣
B.c(ClO﹣)=1.0 mol?L﹣1溶液:Na+、SO32﹣、S2﹣、Cl﹣
C.含有0.1 mol?L﹣1 HCO3﹣的溶液:Na+、Fe3+、NO ![]() 、C6H5O﹣
、C6H5O﹣
D.![]() =0.1 mol?L﹣1的溶液:Na+、K+、CO32﹣、NO3﹣
=0.1 mol?L﹣1的溶液:Na+、K+、CO32﹣、NO3﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验目的可以实现或操作正确的是
A. 用托盘天平称取3.23gNaCl固体
B. 用10mL量筒量取7.50mL稀盐酸
C. 蒸馏时冷凝聚管中冷却水流向是上口进下口出
D. 稀释浓硫酸时,把浓硫酸沿器壁慢慢注入水里,并不断搅拌
查看答案和解析>>
科目: 来源: 题型:
【题目】环扁桃酯是用于治疗心脑血管疾病的重要化合物,它的一种合成路线如图. 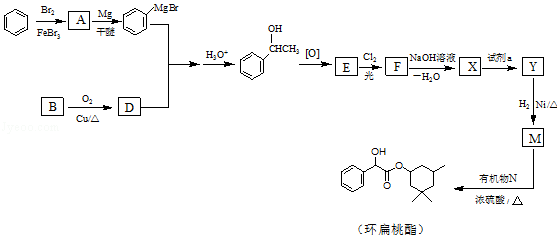
已知: 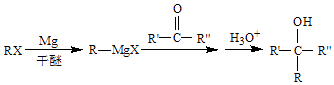 (R、R′、R″代表烃基或氢)
(R、R′、R″代表烃基或氢)
(1)A的结构简式是 .
(2)B→D的化学方程式是 .
(3)红外吸收光谱表明E有C=O键.F的分子式为C8H6Cl2O. ①E的结构简式是 .
②E→F的反应类型是 .
(4)X的结构简式是 .
(5)试剂a是 .
(6)生成环扁桃酯的化学方程式是 .
(7)以CH3CH=CH2、CH3CHO为有机原料,结合题目所给信息,选用必要的无机试剂合成CH2=CHCH=CHCH3 , 写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6、﹣2 | ﹣1 | ﹣2 |
(1)用元素代号标出它们在周期表中对应位置(以下为周期表的一部分). 
(2)B元素处于元素周期表中周期族;
(3)在元素周期表中的分界处,可以找到制半导体材料的元素;
(4)上述五种元素的最高价氧化物对应水化物中酸性最强的是(填化学式);
(5)C和E形成的化合物M,能使酸性高锰酸钾溶液褪色,体现了M的性.
(6)写出D与强碱溶液反应的离子方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】将某溶液逐滴加入Fe(OH)3溶胶内,开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是
A.2 mol·L-1H2SO4溶液B.2 mol·L-1NaOH溶液
C.2 mol·L-1MgSO4溶液D.硅酸溶胶
查看答案和解析>>
科目: 来源: 题型:
【题目】用下图所示实验装置(夹持仪器己略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
A.上下移动①中铜丝可控制SO2的产生与停止
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认有CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目: 来源: 题型:
【题目】Li﹣CuO二次电池的比能量高、工作温度宽,性能优异,广泛应用于军事和空间领域.
(1)Li﹣CuO电池中,金属锂做极.
(2)比能量是指消耗单位质量的电极所释放的电量,用来衡量电池的优劣.比较Li、Na、Al分别作为电极时比能量的大小: .
(3)通过如下过程制备CuO Cu ![]() CuSO4溶液
CuSO4溶液 ![]() Cu2(OH)2CO3沉淀
Cu2(OH)2CO3沉淀 ![]() CuO
CuO
①过程Ⅰ,H2O2的作用是 .
②过程Ⅱ产生Cu2(OH)2CO3的离子方程式是 .
③过程Ⅱ,将CuSO4溶液加到Na2CO3溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如下:
已知:Cu2(OH)2CO3中铜元素的百分含量为57.7%.
二者比值为1:0.8时,产品中可能含有的杂质是 , 产生该杂质的原因是 .
④过程Ⅲ反应的化学方程式是 .
(4)Li﹣CuO二次电池以含Li+的有机溶液为电解质溶液,其工作原理示意如图2.放电时,正极的电极反应式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com