
科目: 来源: 题型:
【题目】请回答下列问题:
I.工业生产纯碱的工艺流程示意图如下:

(1)为除去粗盐水中的Mg2+、Ca2+、SO42-等杂质离子,加入试剂顺序合理的是________。
A.碳酸钠、氢氧化钠、氯化钡 B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡 D.氯化钡、氢氧化钠、碳酸钠
(2)工业生产纯碱工艺流程中,碳酸化时产生的现象是________________。
(3)碳酸化后过滤,滤液A最主要的成分是______________(填写化学式),检验这一成分的阴离子的具体方法是:________________________________。
(4)煅烧制取Na2CO3在_______(填字母序号)中进行。
a.瓷坩埚 b.蒸发皿 c.铁坩埚 d.氧化铝坩埚
II.纯碱在生产生活中有广泛的用途。
(5)工业上,可能用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与氯气反应可制得有效成分为次氯酸钠的消毒液,其反应的离子方程式为________________________。
(6)纯碱可制备重铬酸钠(Na2Cr2O7),铬铁矿中的1molCr2O3反应时需要通入标准状况下O2的体积为_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫在空气中燃烧可以生成SO2 , SO2在催化剂作用下可以被氧化为SO3 , 其热化学方程式可表示为:S(g)+O2(g)═SO2(g)△H=﹣297kJ/mol,SO2(g)+ ![]() O2(g)SO3(g);△H=﹣98.3kJ/mol.如图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6mol SO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量.
O2(g)SO3(g);△H=﹣98.3kJ/mol.如图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6mol SO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量. 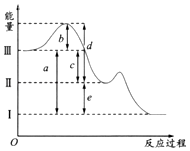
(1)Ⅰ→Ⅱ的反应是(填“吸热”,“放热”)反应.
(2)c为KJ.
(3)图示中b的大小对Ⅲ→Ⅱ反应的△H的影响是 .
A.△H随着b的增大而增大
B.△H随着b的增大而减小
C.△H随着b的减小而增大
D.△H不随b的变化而变化
(4)图中的d+e﹣b=KJ.
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2 . 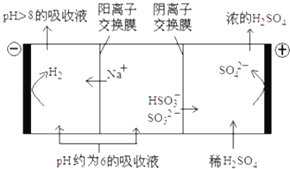
(1)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 .
(2)吸收液吸收SO2的过程中,pH随n(SO32﹣),n(HSO3﹣)变化关系如下表:
n(SO32﹣):,n(HSO3﹣) | 91:9 | 1:1 | 1:91 |
PH | 8.2 | 7.2 | 6.2 |
1表判断NaHSO3溶液显性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.c(Na﹣)=2c(SO ![]() )+c(HSO
)+c(HSO ![]() )
)
b.c(Na﹣)>c(HSO ![]() )>c(SO
)>c(SO ![]() )>c(H﹣)=c(OH﹣)
)>c(H﹣)=c(OH﹣)
c.c(Na+)+c(H+)=c(SO ![]() )+c(HSO
)+c(HSO ![]() )+c(OH﹣)
)+c(OH﹣)
(3)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如下:
①HSO3﹣在阳极放电的电极反应式是 .
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理: .
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以空气和镁为原料制备 Mg3N2 的装置如图所示(夹持和加热装置略去):
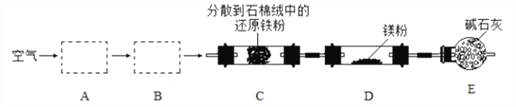
下列说法正确的是
A. 装置 A、B 中可依次加入浓硫酸、NaOH 溶液
B. 装置 E 中碱石灰的作用是吸收尾气
C. 实验时, 应先加热 C,通入一段时间空气后再加热D
D. 若去掉装置 C,对产品纯度无影响
查看答案和解析>>
科目: 来源: 题型:
【题目】镍是重要的有色金属之一,但粗镍中一般含有Fe、Cu及难与酸、碱溶液反应的不溶性杂质而影响使用.现对粗镍进行提纯,具体的反应流程如下: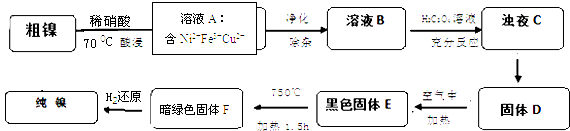
已知:
①2Ni2O3(黑色) ![]() 4NiO(黑色)+O2↑
4NiO(黑色)+O2↑
②
物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS |
Ksp | 8.8×10﹣38 | 2.2×10﹣20 | 5.48×10﹣18 | 3.2×1018 |
根据信息回答:
(1)28Ni在周期表中的第周期;镍与稀硝酸反应的离子方程式为 . 实验表明镍的浸出率与温度有关,随着温度升高镍的浸出率增大,但当温度高于70℃时,镍的浸出率又降低,浸出渣中Ni(OH)2含量增大,其原因为;
(2)在溶液A的净化除杂中,先调节PH=5.5,加热煮沸5min,静置一段时间后,过滤出Fe(OH)3 . 为了得到纯净的溶液B还需要加入以下物质进行除杂(填正确答案标号).
A.NaOH
B.Na2S
C.H2S
D.NH3﹒H2O
(3)已知以下三种物质的溶解度关系:NiC2O4>NiC2O4H2O>NiC2O42H2O.由浊液C得到固体D的操作包括过滤、、(填操作名称); D生成E的化学方程式为
(4)1molE经上述流程得到纯镍,理论上参加反应的氢气为 mol.
(5)测定样品中的镍含量的基本思路是将Ni2+转化为沉淀,通过测量沉淀的质量进一步推算Ni含量.已知Ni2+能与CO32﹣ , C2O42﹣、S2﹣等离子形成沉淀,但测定时常选用丁二酮肟(C4H8N2O2)作沉淀剂,生成分子式为C8H14N4O4Ni的鲜红色沉淀.从实验误差角度分析主要原因为: .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.饮用水就是纯水,是纯净物
B.有机食品,就是有机合成的食品
C.将化工厂的烟囱建高,不能缓解大气污染
D.燃煤时,鼓入过量的空气可以减少酸雨的产生
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各表述与示意图一致的是( )
A.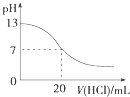
图表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的pH随加入酸体积的变化
B.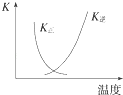 图中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
图中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
C.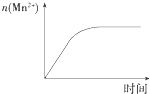
图表示10 mL 0.01 molL﹣1 KMnO4酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
D.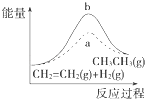
图中a、b曲线分别表示反应CH2═CH2(g)+H2(g)﹣→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.任何情况下,温度都不可能对反应的方向起决定性作用
B.室温下,CH3COOH的KW=1.7×10﹣5 , NH3H2O的Kb=1.7×10﹣5 , CH3COOH溶液中的c(H+)与NH3H2O中的c(OH﹣)相等
C.用pH试纸测定溶液pH的正确操作是,将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
D.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
查看答案和解析>>
科目: 来源: 题型:
【题目】将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+物质的量分别( ) 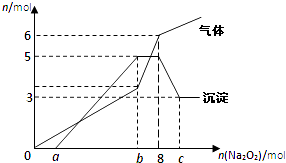
A.2 mol、3 mol、6 mol
B.3 mol、2 mol、6mol
C.2 mol、3 mol、4 mol
D.3 mol、2 mol、2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com