
科目: 来源: 题型:
【题目】将2 mol H2O和2 mol CO置于1 L容器中,在一定条件下,加热至高温,发生如下可逆反应: 2H2O(g)![]()
2H2+O2,2CO+O2![]() 2CO2。
2CO2。
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是________和________,或________和________。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为:n平(O2)= a mol, n平(CO2)=bmol。试求n平(H2O)=________。(用含a、b的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】第三代混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池工作原理示意如下图, 
其总反应式为:H2+2NiOOH ![]() 2Ni(OH)2 , 根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH(填“增大”、“减小”或“不变”),该电极的电极反应式为 .
2Ni(OH)2 , 根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH(填“增大”、“减小”或“不变”),该电极的电极反应式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】聚合物F的合成路线图如图: 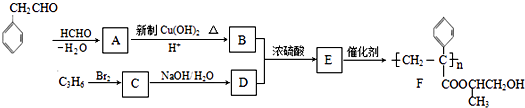
已知:HCHO+RCH2CHO→ 
![]()
![]()
请据此回答:
(1)A中含氧官能团名称是 , C的系统命名为
(2)检验B中所含官能团所用的试剂有;E→F的反应类型是 .
(3)G物质的相对分子质量比 ![]() 的相对分子质量大2,则符合下列条件的G的同分异构体有种. ①分子中含有苯环,且苯环上有两个取代基 ②遇氯化铁溶液变紫色
的相对分子质量大2,则符合下列条件的G的同分异构体有种. ①分子中含有苯环,且苯环上有两个取代基 ②遇氯化铁溶液变紫色
(4)C生成D的反应化学方程式为 , 如果C与NaOH的醇溶液反应,则生成的有机物的结构简式为
(5)参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备 ![]() 的合成路线
的合成路线
查看答案和解析>>
科目: 来源: 题型:
【题目】689 K时,在1 L密闭容器中进行的反应:H2(g)+I2(g)![]() 2HI(g)达到平衡,图甲表示当起始物为1 mol·L-1 H2和1 mol·L-1 I2时,容器内各物质的浓度c的变化与时间t的关系示意图。
2HI(g)达到平衡,图甲表示当起始物为1 mol·L-1 H2和1 mol·L-1 I2时,容器内各物质的浓度c的变化与时间t的关系示意图。

(1)请在图乙中画出当起始物为2 mol·L-1 HI时,容器中各物质的浓度变化与时间的关系示意图。
(2)由图中的事实说明化学平衡具有的特征是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,K2MnO4溶液经酸化后转化为MnO2和KMnO4 . 一种MnO2制备KMnO4的方法如下: 
(1)写出“溶化氧化”的化学反应方程式:;
(2)从溶液②中得到KMnO4粗晶体的方法是;
(3)上述流程中可以循环使用的物质是;
(4)理论上(若不考虑制备过程中的损失与物质循环)1mol MnO2可制的mol KMnO4;
(5)已知293K时醋酸钾的溶解度为217g,硫酸钾的溶解度为11.1g,请解释酸化过程中采用醋酸而不采用盐酸或硫酸的原因: ①不采用盐酸的原因:;
②不采用硫酸的原因:
(6)采用上述流程制备KMnO4产率并不高,为提高产率,还可以采用以下两种方法: ①在K2MnO4溶液中通入氯气,写出该反应的离子方程式;
②电解K2MnO4溶液,电解的总反应离子方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
a、2NO(g)+Cl2(g)2ClNO(g)△H1<0 其平衡常数为K1
b、2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)△H2<0 其平衡常数为K2
(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)△H3的平衡常数K=(用K1、K2表示).△H3=(用△H1、△H2表示).
(2)为研究不同条件对反应a的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2 , 10min时反应a达到平衡.测得10min内V(ClNO)=7.5×10﹣3molL﹣1min﹣1 , 则平衡后n(Cl2)=mol,NO的转化率α1= . 其它条件保持不变,反应(1)在恒压条件下进行,平衡时NO的转化率为α2 , α1α2(填“>”“<”或“=”),平衡常数K1(填“增大”“减小”或“不变”).若要使K1减小,可采用的措施是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 . 直到因加入一滴盐酸后,溶液由黄色变为橙色,并为止.
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示:所用盐酸溶液的体积为 mL.
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是
(A)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
(B)滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
(C)读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(D)酸式滴定管在滴定前有气泡,滴定后气泡消失
(4)某学生根据三次实验分别记录有关数据如表:请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:(NaOH)=(保留小数点后4位).
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000molL﹣1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,X,Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是( ) 
a极板 | b极板 | X电极 | Z | |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇(沸点:64.7oC)是一种清洁能源,制取甲醇的成熟的方法有很多,利用CO2和H2甲醇制甲醇的反应方程式如下:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.4kJ/mol
Ⅰ.一定条件下,向容积为2L恒容密闭容器中充入1.2mol CO2(g)和2.8mol H2(g),在不同温度下达平衡时,CH3OH的体积分数变化曲线如图1所示.
(1)保持T1恒温下,从开始到平衡所需时间为10分钟.测定平衡时容器内压强为P1MPa.
①开始到平衡的平均反应速率v(CO2)=mol/(Lmin)
②该温度下反应的平衡常数K=
(2)使上述反应在T2(T1<T2)的恒温下进行并达平衡.测定到平衡所需是为t2分钟,平衡时容器内压强为P2 MPa.则t210;P2P1(填>、<或=)
Ⅱ.某研究小组通过实验探究不同的氢碳比[n(H2)/n(CO2)]对反应物转化率的影响.
向容积为2L的恒温恒容密闭容器,把总物质的量为4mol的H2 (g)和CO2 (g)以不同的氢碳比[n(H2)/n(CO2)]开始进行反应,分别达到平衡时,测定剩余CH3OH的浓度以计算CO2(g)或H2(g)的转化率.
(3)图2画出了CO2(g)转化率的变化曲线,请在图中画出H2(g)的转化率的变化曲线(以A为起点),并作相应的标注 .
Ⅲ.利用利用CO2和H2也可以制取另一种重要的有机溶剂甲醚CH3OCH3 .
已知2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=﹣25.kJ/mol写出利用CO2和H2制取甲醚的热化学方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】以铬铁矿[主要成分为Fe(CrO2)2 , 含有Al2O3、SiO2等杂质]为主要原料生产重要铬铁矿KClO3、纯碱CO2氧化剂重铬酸钠晶体(Na2Cr2O72H2O)的主要工艺流程如图: 
(1)浸出液中的主要成分为Na2CrO4 . 写出煅烧时主要成分[Fe(CrO2)2]发生反应的化学方程式;同时杂质Al2O3、SiO2液转化为可溶性盐,在浸出液中分别以、(离子符号)存在.
(2)酸化的目的是将Na2CrO4转化为Na2Cr2O7 . 写出反应的离子方程式:; 通过结晶分离得到的Na2Cr2O72H2O中可能含有的杂质除了Na2SO4外,还有 . 进一步提纯的方法是 .
(3)根据有关国家标准,含CrO42﹣的废水要经化学处理,使其浓度降至5.0×10﹣7mol/L以下才能排放.含CrO42﹣的废水处理通常有以下两种方法. ①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10﹣10],再加入可溶性硫酸盐处理多余的Ba2+ . 加入可溶性钡盐后的废水中Ba2+的浓度应不小于mol/L,后续废水处理方能达到国家排放标准.
②还原法:CrO42﹣ ![]() Cr3+
Cr3+ ![]() Cr(OH)3 . 用该方法处理10m3 CrO42﹣的物质的量浓度为1.5×10﹣3mol/L的废水,至少需要绿矾(FeSO47H2O)kg.
Cr(OH)3 . 用该方法处理10m3 CrO42﹣的物质的量浓度为1.5×10﹣3mol/L的废水,至少需要绿矾(FeSO47H2O)kg.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com