
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列判断正确的是
A.在18g18O2中含有NA个氧原子
B.22.4LCO2含有的共价键数目是4NA
C.1molCl2参加反应转移电子数一定为2NA
D.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列装置说法正确的是( )
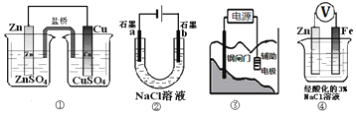
A. 装置①中,盐桥中的Cl-移向CuSO4溶液
B. 装置②工作一段时间后,a极附近溶液的pH降低
C. 装置③中钢闸门应与外接电源的正极相连获得保护
D. 装置④中电子由Zn经导线流向Fe,Zn极发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/( mol·L1) | 0.1 | 0.2 | 0 |
平衡浓度/( mol·L1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是
A.反应达到平衡时,X和Y的转化率相等
B.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
D.若该反应的正反应方向为放热反应,升高温度,化学反应速率增大,反应的平衡常数也增大
查看答案和解析>>
科目: 来源: 题型:
【题目】Hagemann酯的合成路线如下(部分反应条件略去):

(1)Hagemann酯的分子式为_____________。
(2)已知A→B、B→C均为加成反应,则B的结构简式是__________。
(3)E→F的化学方程式是_______________。
(4)已知Hagemann酯的一种同分异构体有下列结构特征:
①含有苯环且苯环上只有一个取代基;②除苯环外核磁共振氢谱吸收峰只有1个;③存在甲氧基(-OCH3)。则该同分异构体的结构简式为____________。
(5)下列说法正确的是________________。
①G为芳香族化合物
②A能和HCl加成得到聚氯乙烯的单体
③G与NaOH溶液共热,能得到甲醇
④在Ni催化下,1molHagemann酯最多能与2 mol H2发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质:①白磷 ②金刚石 ③石墨 ④二氧化硅⑤甲烷 ⑥四氯化碳 ⑦铵根离子,其分子结构或晶体结构单元中存在正四面体的是( )
A. ①②④⑤⑥⑦ B. ①②⑤⑥ C. ②⑦ D. ③④⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】碳和氮的化合物与人类生产、生活密切相关.

(1)在一恒温、恒容密闭容器中发生反应:Ni (s)+4CO(g)![]() Ni(CO)4(g),△H<0.利用该反应可以将粗镍转化为纯度达99.9%的高纯镍.下列说法正确的是 (填字母编号).
Ni(CO)4(g),△H<0.利用该反应可以将粗镍转化为纯度达99.9%的高纯镍.下列说法正确的是 (填字母编号).
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,△H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v正[Ni(CO)4]=v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(2)CO与镍反应会造成含镍催化剂的中毒.为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫.
已知:CO(g)+1/2QUOTE\*MERGEFORMATO2(g)=CO2(g)△H=﹣Q1 kJmol﹣1
S(s)+O2(g)=SO2(g)△H=﹣Q2 kJmol﹣1
则SO2(g)+2CO (g)=S(s)+2CO2(g)△H= .
(3)对于反应:2NO(g)+O2═2NO2(g),向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图1).
①比较P1、P2的大小关系: .
②700℃时,在压强为P2时,假设容器为1L,则在该条件平衡常数的数值为 (最简分数形式)
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图2所示.该电池在使用过程中石墨I电极上生成氧化物Y,那么石墨II极电极反应式为 .若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L.
查看答案和解析>>
科目: 来源: 题型:
【题目】(共6分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g)![]() Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
(1)该反应的氧化剂是 ,2molN2参加反应转移电子数为 。
(2)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图。

图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 。
(3)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是
(提示:272 = 729)
查看答案和解析>>
科目: 来源: 题型:
【题目】H2X 和H2Y均为二元弱酸,常温下,将NaOH 溶液分别加到H2X 和H2Y的溶液中,在不同pH 环境下不同形态的粒子(即酸、酸式酸根、酸根离子)的组成分数如图所示:
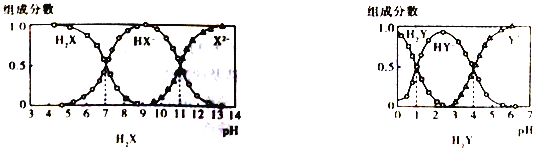
下列说法正确的是
A. 在pH=7的溶液中HX-、X2-、HY-和Y2-能大量共存
B. 向Na2X溶液中加入少量H2Y 溶液,发生反应:X2-+H2Y==HX-+HY-
C. 1L.0.1mol·L-1NaHY溶液中n(HY-)+2n(Y2-)+n(H2Y) =0.1mol
D. HX-的水解平衡常数为Kb=10-7
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.0ml于锥形瓶中,加入10.0ml的KI溶液(足量),发生的反应为:Cl2+2KI=2KCl+I2,滴入指示剂2~3滴。
②②取一滴定管依次用自来水、蒸馏水洗净后,再用0.01mol·L-1Na2S2O3溶液润洗,然后装入0.01mol·L-1Na2S2O3溶液到0刻度以上,排出下端尖嘴内的气泡,调整液面至0刻度或0刻度下某一位置,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+ 2Na2S4O6 试回答下列问答:
(1)步骤①加入的指示剂是_______________________________。
(2)步骤②应使用________式滴定管。
(3)判断达到滴定终点的实验现象是___________________________________;
(4)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,下列情况对实验结果无影响的是____________
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定时将标准液溅出锥形瓶外
(5)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11,草酸H2C2O4,K1=5.9×10-2,K2=6.4×10-50.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)。若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____________。(选填编号)
A.c(H+)>c(HC2O4-)>c[HCO3-)>c[CO32-) B.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-) D.c(H2CO3) >c(HCO3-)>c(HC2O4-)>c(CO32-)
(6)已知:①难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10 ②25℃时,2.0×10-3mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:请根据以下信息回答下列问题:
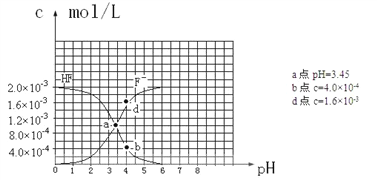
①25℃时,HF电离平衡常数的数值Ka≈_______________________________。
②4.0×10-3 mol·L-1HF溶液与4.0×10-4 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。_______________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com