
科目: 来源: 题型:
【题目】高纯硅晶体是信息技术的重要材料。
(1)工业上用石英和焦炭可以制得粗硅。已知反应过程的能量变化如下图


写出用石英和焦炭制取粗硅的热化学方程式______________________________。
(2)某同学设计下列流程制备高纯硅:

①Y的化学式为____________________。
②写出反应I的离子方程式________________________________________。
③写出反应IV的化学方程式________________________________________。
④甲烷分解的温度远远高于硅烷(SiH4),用原子结构解释其原因______________________。
(3)将粗硅转化成三氯硅烷(SiHCl3),进一步反应也可以制得粗硅。其反应:SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比的变化关系如图所示。下列说法正确的是__________(填字母)。
Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比的变化关系如图所示。下列说法正确的是__________(填字母)。

A.该反应是放热反应
B.横坐标表示的投料比可以是![]()
C.该反应的平衡常数随温度升高而增大
D.实际生产中为提高SiHCl3的利用率,可以适当增大压强
查看答案和解析>>
科目: 来源: 题型:
【题目】苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+ , 现榨的苹果汁在空气中会由Fe2+变为Fe3+ . 若榨汁时加入维生素C,可有效防止这种现象的发生.这说明维生素C具有( )
A.还原性
B.氧化性
C.碱性
D.酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是
A. 氯化铵溶液,加水稀释时,c(NH4+)/c(Cl-)的值一定减小
B. 0.1 mol·L-1的盐酸和0.1 mol·L-1的弱酸HA溶液分别加水稀释10倍:pH(HA) > pH(盐酸)
C. 已知25℃时,HA的Ka=6.25×10—5,当pH为5.0时,HA溶液中 = 0.16
= 0.16
D. 某二元酸的酸式盐NaHA溶液中必然存在:c(H+)+c(A2—)=c(OH—)+c(H2A)
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在实验室利用氢氧化钠、盐酸分离铁粉和铝粉混合物,转化关系如下如所示:下列说法不正确的是( )

A. x为NaOH溶液,y为盐酸
B. a→b发生的反应为:AlO2-+H++H2O=Al(OH)3↓
C. 按照本流程,x和y调换后也能达到实验目的
D. b、c既能与强酸又能与强碱反应
查看答案和解析>>
科目: 来源: 题型:
【题目】根据元素周期表和元素周期律,下列叙述不正确的是( )
A. 气态氢化物的稳定性:HF>H2O>NH3
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 右图所示实验可证明元素的非金属性:Cl>C>Si

D. 第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目: 来源: 题型:
【题目】由N、B等元素组成的新型材料有着广泛用途。
(1)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅的制造;由第二周期元素组成的与BCl3互为等电子体的阴离子为_______(填离子符号,填一个)。
(2)氨硼烷(H3N→BH3)和Ti(BH4)3均为广受关注的新型化学氢化物储氢材料.
①H3N→BH3中B原子的外围电子排布图_________。
②Ti(BH4)3由TiCl3和LiBH4反应制得,写出该制备反应的化学方程式____;基态Ti3+的成对电子有___对,BH4-的立体构型是____;Ti(BH4)3所含化学键的类型有____;
③氨硼烷可由六元环状化合物(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3;与上述化学方程式有关的叙述不正确的是 _____________
A.氨硼烷中存在配位键
B.第一电离能:N>O>C>B
C.反应前后碳原子的轨道杂化类型不变
D.CH4、H2O、CO2都是非极性分子
(3)磷化硼(BP)是受到高度关注的耐磨材料,如图1为磷化硼晶胞;
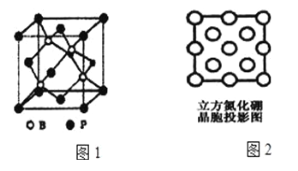
①晶体中P原子填在B原子所围成的____空隙中。
②晶体中B原子周围最近且相等的B原子有____个。
(4)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,其结构和硬度都与金刚石相似,但熔点比金刚石低,原因是__________。图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置______。其中“●”代表B原子,“×”代表N原子。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于弱电解质的说法中正确的是( )
A. 弱电解质需要通电才能发生电离
B. 醋酸溶液达到电离平衡时,不存在CH3COO-+H+![]() CH3COOH
CH3COOH
C. H2SO4是共价化合物,所以它是弱电解质;NaOH是离子化合物,所以它是强电解质
D. 弱电解质溶液中,既有溶质分子,又有溶质电离出来的离子
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,下列有关说法错误的是

A. 该反应的化学方程式为3X+Y![]() 2Z
2Z
B. 2 min时,反应达最大限度,但化学反应仍在进行
C. 2 min末时,Z的反应速率为0.05 mol·L-1·min-1
D. 反应达到平衡时,压强是开始时的0.9倍
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对核酸的叙述中,正确的有 ( )
A. 病毒体内的核酸是DNA和RNA
B. 核酸是由若干个核苷酸脱水缩合形成的长链,其中DNA一般由一条核苷酸链组成,RNA一般由两条核苷酸链构成
C. 构成核酸的碱基有5种,核苷酸也有5种
D. DNA分子携带的遗传信息就是其脱氧核苷酸的排列顺序
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.摩尔是国际科学界建议采用的一种物理量
B.国际上规定,0.012 kg碳原子所含有的碳原子数目为1摩尔
C.氢氧化钠的摩尔质量是40g
D.氧气的摩尔质量以g/mol为单位时在数值上等于它的相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com