
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A. 白磷和红磷互为同素异形体 B. CH3-CH2OH和 CH3-O-CH3 互为同分异构体
C. ![]() 和
和![]() 互为同位素 D. 分子间作用力越大,分子越稳定。
互为同位素 D. 分子间作用力越大,分子越稳定。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
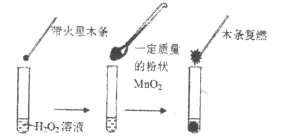
(1)甲同学欲用下图所示实验来证明![]() 是
是![]() 分解反应的催化剂。该实验________(填“能”或“不能”)达到目的,原因是___________。
分解反应的催化剂。该实验________(填“能”或“不能”)达到目的,原因是___________。
(2)为探究![]() 的量对催化效果的影响,乙同学分别量取
的量对催化效果的影响,乙同学分别量取![]() 1%
1%![]() 加入容器中,在一定质量范围内,加入不同质量的
加入容器中,在一定质量范围内,加入不同质量的![]() ,测量所得气体体积,数据如下:
,测量所得气体体积,数据如下:
| 0.1 | 0.2 | 0.4 |
40s末 | 49 | 61 | 86 |
由此得出的结论是______________。
(3)为分析![]() 和
和![]() 对
对![]() 分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有
分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有![]() )
)
试管 | I | II | III |
滴加试剂 | 5滴 | 5滴 | 5滴0.3 |
产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
结论是___________,实验III的目的是___________。
(4)①查阅资料得知:将作为催化剂的![]() 溶液加入
溶液加入![]() 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中![]() 均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是__________和___________(按反应发生的顺序写)。
均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是__________和___________(按反应发生的顺序写)。
②在上述实验过程中,分别检测出溶液中有二价锰、二价铁和一价铜,由此得出选择作为![]() 分解反应的催化剂需要满足的条件是___________。
分解反应的催化剂需要满足的条件是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】![]() __________
__________
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
|
|
|
稀硫酸 | ||
1 | 3.0 | 2.0 | 1.0 | 2.0 | 4.0 |
2 | 2.0 | 3.0 | 1.0 | 2.0 | 5.2 |
3 | 1.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是___________。
(2)利用实验1中数据计算,用![]() 的浓度变化表示的平均反应速率为:
的浓度变化表示的平均反应速率为: ![]() _____________
_____________
(3)该小组同学根据经验绘制了![]() 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中
随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中![]() 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
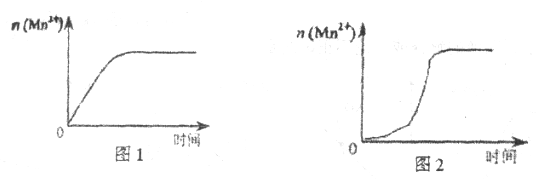
①该小组同学提出的假设是____________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
|
|
|
稀硫酸 | |||
4 | 3.0 | 2.0 | 1.0 | 2.0 | ____ | t |
③若该小组同学提出的假设成立,应观察到的现象是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是学习物质结构和性质的重要工具,如图是元素周期表的一部分,请参照元素 ①~⑩在表中的位置回答下列问题.
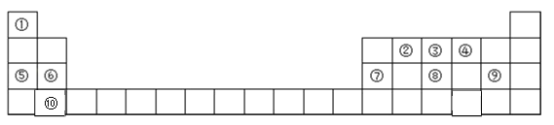
(1)在这 10 种元素中,原子半径最大的是_________(填元素符号)。
(2)⑧、⑨的最高价氧化物对应水化物的酸性强弱顺序是______>_____(填化学式)。
(3)写出①、④元素组成比为1:1的化合物的电子式是_________。
(4)④⑤⑥⑦对应的离子半径最小的是_________(填离子符号)。
(5)写出实验室制取③的气态氢化物的化学方程式_________。
(6)⑦单质可用来制造⑦—空气燃料电池,该电池通常以氯化钠或氢氧化钾溶液为电解质溶液,通入空气的电极为正极。若以氯化钠为电解质溶液时,正极的反应式为_________。若以氢氧化钾溶液为电解质溶液时,电池的总反应式为_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】接触法制硫酸工艺中,主反应在450℃并有催化剂存在下进行:![]()
![]()
(1)恒温恒容条件下,下列能说明此反应已达平衡的是________。
①![]()
②容器中气体的平均摩尔质量不随时间而变化
③容器中气体的密度不随时间而变化
④容器中气体分子总数不随时间而变化
(2)下列有关该反应速率的叙述中,正确的是_________。
a. 升高温度可以增大活化分子百分数,加快反应速率
b. 使用催化剂提高二氧化硫的转化率
c. 使用催化剂可以使反应物分子平均能量升高,加快反应速率
d. 缩小容器体积增大压强不能增大活化分子百分数,但可以加快反应速率
(3)下图表示将![]() 和
和![]() 置于2L密闭容器中,当其他条件一定时,
置于2L密闭容器中,当其他条件一定时, ![]() 的平衡转化率a随X的变化关系,
的平衡转化率a随X的变化关系, ![]() 代表压强或温度。X代表的物理量是___________。A对应条件下平衡常数K=___________。
代表压强或温度。X代表的物理量是___________。A对应条件下平衡常数K=___________。

(4)一定温度下,在容积不变的密闭容器中充入![]() 和
和![]() ,达平衡时
,达平衡时![]() 的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后
的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后![]() 的体积分数仍为a%的是__________。
的体积分数仍为a%的是__________。
a. ![]() b.
b. ![]()
c. ![]() d.
d. ![]()
(5)![]() 与
与![]() 反应生成
反应生成![]() ,
, ![]() 电离方程式为___________,向
电离方程式为___________,向![]() 溶液中加入
溶液中加入![]() 固体,则电离平衡往__________反应方向移动。
固体,则电离平衡往__________反应方向移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铁矿(主要成分为FeS2)的有效利用对环境具有重要意义。
(1)在酸性条件下催化氧化黄铁矿的物质转化关系如图1所示。
①图1转化过程的总反应中,FeS2作__________(填“催化剂”“氧化剂”或“还原剂”,下同)。该转化过程中NO的作用是________。
②写出图1中Fe3+与FeS2反应的离子方程式:________________________。


(2)FeS2氧化为Fe3+的过程中,控制起始时Fe2+的浓度、溶液体积和通入O2的速率不变,改变其他条件时,Fe2+被氧化的转化率随时间的变化如图2所示。
①加入NaNO2发生反应:2H++3NO2-=NO3-+2NO↑+H2O。该反应中若有6molNaNO2完全反应,转移电子的物质的量为________mol。
②加入NaNO2、KI发生反应:4H++2NO2-+2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】大气中的部分碘源于![]() 对海水中
对海水中![]() 的氧化。其科学小组进行
的氧化。其科学小组进行![]() 与含
与含![]() 溶液反应的相关研究:
溶液反应的相关研究:
(1)![]() 将
将![]() 氧化生成
氧化生成![]() 的过程由3步反应组成:
的过程由3步反应组成:
①![]()
![]()
②![]()
![]()
③![]()
![]()
用热化学方程式表示![]() 氧化
氧化![]() 生成
生成![]() 的反应______。
的反应______。
(2)![]() 在水中易分解,一定条件下,
在水中易分解,一定条件下, ![]() 的浓度减少一半时所需的时间(t)如下表所示。已知:
的浓度减少一半时所需的时间(t)如下表所示。已知: ![]() 的起始浓度为
的起始浓度为![]()
pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①![]() 增大能加速
增大能加速![]() 分解,表明对
分解,表明对![]() 分解起催化作用的是___________。
分解起催化作用的是___________。
②根据表中数据,推测![]() 在下列条件下分解速率依次增大的顺序为__________(填字母代号)
在下列条件下分解速率依次增大的顺序为__________(填字母代号)
a. 40℃、![]() b. 10℃、
b. 10℃、![]() c. 30℃、
c. 30℃、![]()
(3)![]() 在KI溶液中存在下列平衡:
在KI溶液中存在下列平衡:![]() 。测得不同温度下该反应的平衡常数如图所示,下列说法正确的是__________。
。测得不同温度下该反应的平衡常数如图所示,下列说法正确的是__________。

A. 反应![]() 的
的![]()
B. 利用该反应可以除去硫粉中少量的碘单质
C. 在上述平衡体系中加入苯,平衡不移动
D. 25℃时,在上述平衡体系中加入少量![]() 固体,平衡常数K小于680
固体,平衡常数K小于680
(4)将![]() 溶于
溶于![]() 中,得到紫红色的溶液,再加入一定浓度的
中,得到紫红色的溶液,再加入一定浓度的![]() 溶液,现象如图所示:
溶液,现象如图所示:

①上层溶液中含碘元素的微粒有_______________(用化学符号表示)。
②由实验现象可推测关于![]() 溶解性的结论是______________。
溶解性的结论是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学上常用AG 表示溶液中的酸碱度,AG=lg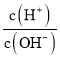 。25℃时,用0.100mol·L-1的NaOH 溶液滴定20.00mL 0.100mol·L-1HNO2溶液,AG与所加NaOH 溶液的体积(V)关系如图所示,下列说法正确的是( )
。25℃时,用0.100mol·L-1的NaOH 溶液滴定20.00mL 0.100mol·L-1HNO2溶液,AG与所加NaOH 溶液的体积(V)关系如图所示,下列说法正确的是( )
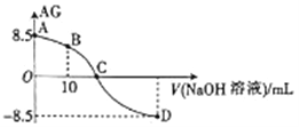
A. B点溶液中存在c(H+)-c(OH-)=c(NO2-)-c(HNO2)
B. D点溶液中的pH=11.25
C. C点时,加入NaOH 溶液的体积为20.00 mL
D. 25 ℃时,HNO2 的电离平衡常数Ka=1.0×10-5.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com