
科目: 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:


(1)从氯化钾溶液中得到氯化钾固体,选择装置____________(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置____________。
(2)从碘水中分离出I2,选择装置_________,该分离方法的名称为___________。
(3)装置A中①的水的进出方向是_________,A中玻璃仪器的名称分别是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量简量取30mL0.50 molL-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.50molL-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)如果用30mL0.50mol/L硫酸与70mL0.50mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量___________(填“相等”、“不相等”),所求中和热___________(填“相等”、“不相等”),简述理由_____________________。
(2)某实验小组配制0.50mol/LNaOH溶液,若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体_____________________g。
(3)若用KOH代替NaOH,对测定结果___________(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果_____________(填“有”或“无”)影响。
(4)①近似认为0.50 molL-1硫酸和0.50 molL-1NaOH溶液密度都是1g·cm3,中和后溶液温度上升了4℃,生成溶液的比热容c=4.18J·(g·℃)-1,则中和热△H=______(小数点后保留一位有效数字)。
②上述实验结果与-57.3kJ·mol-1有偏差,产生偏差的原因可能是____________(填字母)。
A.实验装置保温隔热效果差
B.量取NaOH溶液体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
查看答案和解析>>
科目: 来源: 题型:
【题目】I.在一定温度下将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)=- 2C(g)+ 2D(g),2 分钟末反应达到平衡状态,生成了0.6mol D,回答下列问题:
(1)用D表示2min内的平均反应速率为____________,A的转化率为_____________。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度_________(填“增大”、“减少”或“不变”)。
(3)若开始时只加C和D各4/3mol,要使平衡时各物质的质量分数与原平衡相等,则还应加入_____________mol B 物质。
(4)若向原平衡体系中再投入1molA和1molB,B的转化率_________(填“增大”、“减少”或“不变”)。
II.有人设计出利用CH3OH 和O2的反应,用铂电极在KOH 溶液中构成原电池。电池的总反应类似于CH3OH 在O2中燃烧,则:
(1)每消耗1molCH3OH 可以向外电路提供___________mole-;
(2)负极电极反应式为________________________。
(3)电池放电后,溶液的pH_________(填“增大”、“减少”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O 4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是__________。
(2)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填序号)。
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
(3)0.1 molL-1的H2C2O4溶液与0.1 molL-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:CH3COONa______NaClO,两溶液中:[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(5)向0.1 molL-1CH3COOH 溶液中滴加 NaOH 溶液至 c(CH3COOH): c(CH3COO-)=5 : 9,此时溶液pH=_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂的工业废水中含有大量的“FeSO4”、较多的Cu2+和少量的Na+。为了减少污染变废为宝,工厂计划从该废水中回收硫酸亚铁和铜。根据流程图,完成回收硫酸亚铁和铜的简单实验方案。回答下列问题:

(1)加入原料①为____________;操作②为___________;
(2)固体A为____________;
(3)写出有关反应的化学方程式__________________。
查看答案和解析>>
科目: 来源: 题型:
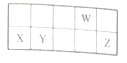
【题目】短周期元素W、X、Y、Z在周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20。下列说法正确的是
A. X的简单离子与Z的简单离子具有相同的电子层结构
B. 最简单氢化物的稳定性:W>Y
C. 原子半径:Y>X
D. 化合物YW2和YZ4中均含有离子键
查看答案和解析>>
科目: 来源: 题型:
【题目】按下列实验方法操作,能达到要求的是( )
A.用托盘天平称量25.20g氯化钠固体
B.实验室制取蒸馏水时,圆底烧瓶中加些碎瓷片可防止暴沸
C.加热饱和FeCl3溶液制备Fe(OH)3胶体
D.将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】请回答下列问题:
(1)纯水在T℃时,pH=6,该温度下0.1 molL-1 的NaOH 溶液中,由水电离出的c(OH-)=__________ molL-1。
(2)在25℃下;将amol·L-1的NaX溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a__________0.01(填“>”、“<”或“=”);用含a的代数式表示HX 的电离常数 Ka=________。
(3)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-aKJ·mol-1 (a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-bKJ·mol-1 (b>0)
若用标准状况下5. 6LCO将NO2还原至N2(CO完全反应),则整个过程中转移电子的物质的量为_____ mol,放出的热量为_________ kJ(用含有a和b的代数式表示)。
(4)已知AgCl、Ag2CrO4 (砖红色) 的Ksp分别为2×10-10和2.0×10-12。分析化学中,测定含氯的中性溶液中Cl- 的含量,以K2CrO4作指示剂,用AgNO3溶液滴定。滴定过程中首先析出沉淀_________,当溶液中Cl- 恰好完全沉淀(浓度等于1.0×10-5 mol·L-1) 时,此时溶液中c(CrO42-)等于__________ molL-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有73g氯化氢(HCl)气体,则:
(1)该气体的摩尔质量为_____________。
(2)该气体的物质的量为________mol,所含分子总数为_________个。
(3)该气体在标准状况下的体积为_____________L。
(4)可用于分离或提纯物质的方法有①过滤 ②结晶 ③升华④分液(填序号)。
a.除去石灰水中悬浮的碳酸钙颗粒_________;
b.除去氯化钠中混有的碘单质(碘易由固态变为气态)__________;
c.分离水与苯的混合物____________。
(5)在标准状况下,测得1.92g某气体的体积为672ml计算此气体的相对分子质量__________。
(6)N2、CO2、SO2三种气体的质量比为7:11:16时,它们的分子个数比为_______;物质的量之比为___________;同温同压下体积比为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com