
科目: 来源: 题型:
【题目】从含铜丰富的自然资源黄铜矿(主要成分为CuFeS2)中冶炼铜的工艺流程如下:

已知: ![]() 。
。
(1)若“过滤1”所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为______。
(2)“除硫”时加入浓盐酸发生反应的离子方程式为_____________________________。
(3)“过滤3”所得滤液中可以循环使用的物质为______________、_____________。
(4)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,发生的反应为![]() 、
、![]() 。此工艺与前一工艺相比主要缺点有______________________(任答一点)。
。此工艺与前一工艺相比主要缺点有______________________(任答一点)。
(5)铜溶解于H2O2和H2SO4的混合溶液中可制备CuSO4。测定溶液中Cu2+浓度的方法:准确量取V1 mL溶液于锥形瓶中,调节pH至3~4,加入过量KI溶液,充分反应后,滴加2滴淀粉溶液,再慢慢滴加c mol/L的Na2S2O3标准溶液至恰好完全反应,消耗Na2S2O3标准溶液V2 mL。上述过程中发生的反应为![]() 、
、![]() 。
。
①“恰好完全反应”时溶液的颜色变化为___________________。
②溶液中Cu2+的物质的量浓度为________________________(用含c、V1、V2的代数式表示)mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】在浓度均为4.0 mol·L-1的盐酸和硫酸各100 mL溶液中,分别加入等质量的锌粉,充分反应后生成气体体积比为2∶3,则加入锌粉的质量是
A. 6.5 g B. 13.0 g C. 19.5 g D. 26.0 g
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分

(1)⑤⑥⑦⑨⑩的离子半径由大到小的顺序为______________________(用离子符号表示)。
(2)③与⑩形成的一种化合物每个原子最外层都满足8e-结构,写出该化合物的电子式________。
(3)①②两种元素以原子个数比为3:1形成的一种化合物,写出其二氯取代物的结构简式:_____。
(4)与③同主族的元素的化合物亚磷酸H3PO3是二元弱酸,写出H3PO3与过量的NaOH溶液反应的离子方程式__________________________________。
(5)由④⑥两种元素组成的一种化合物加入到硫酸亚铁溶液中,产生红褐色沉淀,但无气体产生,写出该反应的离子方程式__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知丙二酸脂可以与不饱和醛酮(如烯醛、炔酮等)、卤代烃发生反应:

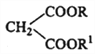 + R3Cl
+ R3Cl 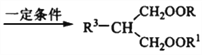 +HCl
+HCl
有机化合物H的合成路线如下:
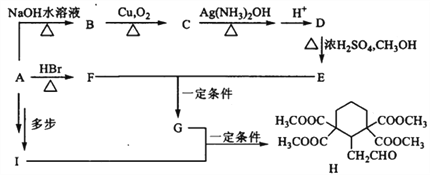
(1)A的分子式为C3H7OBr,核磁共振氢谱显示其中有四组峰,峰面积比1∶2∶2∶2,写出A中含氧官能团名称______________;F的系统命名是_______________。
(2)在碱性条件下,C与足量新制氢氧化铜悬浊液反应的化学方程式是:____________。
(3)B、D按1∶1形成的高分子化合物的结构简式为_____________________________________。
(4)E和F按1∶1反应时得到J(C8H12O4),J的结构简式为___________________________________。
(5)已知G的分子式为C13H20O8,写出同时满足下列条件的G的同分异构体:____________。
①可水解得到4分子甲醇;②其一氯代物仅有两种
(6)Ⅰ只含C、H、O,则Ⅰ的分子式为____________,向Ⅰ中加入少量溴水,发现溴水褪色,但这不能说明其中含有不饱和碳碳键,原因是_________________。
(7)由A经多步反应制得Ⅰ,写出合成路线______________(其他试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼普遍存在于蔬果中,是维持骨的健康和钙、磷、镁正常代谢所需要的微量元素之一。回答下列问题:
(1)硼原子核外电子占据最高能层的符号是__________,占据最高能级的电子云轮廓图形状为___________。价层电子的轨道表达式(电子排布图)为____________。
(2)硼原子的第二电高能(I2)和第三电离能(I3)的大小关系为:I2______I3(填“>”或“<”),原因是____________。
(3)BF3可用于制造火箭的高能燃料。其分子构型为___________,已知BF3分子中F原子和B原子采用同种杂化方式为____________,BF3分子还中存在大π键,可用符号![]() 表示(其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为
表示(其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为![]() ),则分子中的大π键应表示为____________。
),则分子中的大π键应表示为____________。
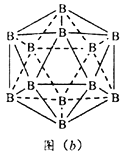
(4)硼酸(H3BO3)晶体为层状结构。其中一层的结构片段如图(a)所示,将这些H3BO3分子聚集在一起的作用为____________。
(5)晶体拥有多种变体,但其基本结构单元都是由硼原子组成的正二十面体,如图(b),每个顶点为个硼原子,构成的三角形均为等边三角形,若该结构单元中有10个原子为10B(其余为11B),那么该结构单元有_________种不同类型。
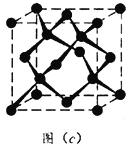
(6)立方氮化硼(BN)晶体与金刚石晶体互为等电子体,图(c)为金刚石晶体的晶胞,立方氮化硼晶体可以取出多种晶胞。其中一种晶胞中N全部位于晶胞体内,则B处于____________位置。

查看答案和解析>>
科目: 来源: 题型:
【题目】镍废料中主要含有Ni,还有少量的Cu、Fe、Pb等。现从中制取Ni2O3,可用于制造人造卫星、宇宙飞船的高能电池,也可用于制成镍镉碱性电池。生产流程见下:

已知0.010mol/L金属离子在不同pH下的沉淀情况如下:
Fe3+ | Cu2+ | Ni2+ | Fe2+ | |
开始沉淀pH | 3.0 | 5.0 | 7.4 | 9.7 |
完全沉淀pH | 4.0 | 6.5 | 9.0 | 11 |
回答下列问题:
(1)加入碳酸钙调pH的目的是____________________________________________,“沉渣2”的主要成分是____________,必须先过滤“沉渣1”后再进行“除Cu”的原因是______________________________________________________________________。
(2)用离子方程式解释加入NH4F“除Ca”的过程_________________。
(3)“酸浸”时参与反应的H2SO4与HNO3物质的量比保持为3∶2,此时Ni单质所发生的化学方程式为___________________________________________。
(4)“操作X”是__________、__________,煅烧时产生两种气体的成分是________。
(5)向NiO中加入盐酸溶解,待完全溶解后,加入足量NaOH溶液,再加入NaClO溶液,写出其中和NaClO相关的反应的离子方程式为_________________________________。
(6)根据上表数据,计算当0.010mol/LNiSO4溶液中Ni2+完全沉淀时的c(Ni2+)=______mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】H2C2O4为二元弱酸,20 ℃时,配制一组c(H2C2O4) + c(HC2O4-) + c(C2O42-)= 0.100mol/L的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )

A. pH = 2.5的溶液中:c(H2C2O4) +c(C2O42-) > c(HC2O4-)
B. c(Na+) = 0.100 mol/L的溶液中:c(H+) +c(H2C2O4) = c(C2O42-)+ c(OH-)
C. c(HC2O4-) = c(C2O42-)的溶液中:c(Na+) > 0.100 mol/L + c(HC2O4-)
D. pH = 7.0 的溶液中,2c(Na+) = c(C2O42-)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:25℃时某些弱酸的电离平衡常数。下面图像表示常温下稀释CH3COOH,HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是( )


A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度大小关系为:c(Na+) > c(ClO-) > c(CH3COO-)> c(OH-) > c(H+)
B. 向NaClO溶液中通少量CO2的离子方程式为:2ClO- + CO2 + H2O = 2HClO + CO32-
C. 图像中a、c两点处的溶液中 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点对应酸的总浓度大于b点酸的总浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com