
科目: 来源: 题型:
【题目】室温下如图,关闭活塞,在左右两室(体积相同)各充入一定量H2和Cl2,且恰好使两容器内气体密度相同,打开活塞,点燃使H2与Cl2充分反应生成氯化氢气体:H2+Cl2=2HCl,恢复到原温度后,下列判断正确的是

A. 开始时左右两室分子数相同
B. 最终容器内无H2存在
C. 反应前后H2室压强相同
D. 最终容器内密度与原来相同
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中的溶质足量),当闭合该装置的电键K时,观察到电流表的指针发生了偏转。

请回答下列问题:
(1)甲池为_________(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为______。
(2)丙池中F电极为____(填“正极”、“负极”、“阴极”或“阳极”),该池总反应的方程式为_____。
(3)当乙池中C极质量减轻4.32g时,甲池中B电极理论上消耗O2的体积为_____mL(标准状况)。
(4)一段时间后,断开电键K。下列物质能使乙池恢复到反应前浓度的是______(填字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu(OH)2CO3
(5)甲醇和乙醇都可以做燃料。已知乙醇液体完全燃烧生成CO2气体和1mol液态水时放出热量453.3kJ,请写出乙醇燃烧的热化学方程式:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是
A. 醋酸钠、纯碱、盐酸和生石灰分别属于酸、碱、盐和氧化物
B. 汽油、酶和纤维素分别属于油脂、蛋白质和多糖
C. 只要功夫深,铁杵磨成针和野火烧不尽,春风吹又生分别是化学变化、物理变化
D. 石墨、水银、氯化钠分别属于非金属单质、金属单质、电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关溶液配制说法错误的是( )
A. 称取12.5g胆矾(CuSO4·5H2O)溶于水中,并加水稀释至500mL,所得溶液物质的量浓度为0.1mol·L-1
B. 取58.5 g NaCl固体放入1 L水中充分溶解,所得溶液中NaCl的物质的量浓度为1 mol·L-1
C. 将100g5%的食盐水加热蒸发掉50g水后,所得溶液中NaCl的质量分数为10%
D. 将浓度为2 mol·L-1硫酸钠溶液10 mL加水稀释至200 mL,所得溶液浓度为0.1mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】2017年5月18日,中国国土资源部地质调查局宣布,我国在南海进行的可燃冰试采获得成功,成为全球第一个海域试采可燃冰成功的国家,可燃冰即天然气水合物,甲烷含量占80%至99.9%。化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇或合成氨,回答下列问题:
(1)甲醇是一种用途广泛的化工原料,工业上常用下列两种反应制备甲醇:
CO(g)+2H2(g)=CH3OH(g) △H1 =-90kJ·mol-1 K1
CO2(g)+3H2(g)= CH3OH(g)+H2O(l) △H2 K2
己知: CO(g)+H2O(g)= CO2(g)+H2(g) △H3 =-41.1kJ·mol-1 K3
H2O(l)=H2O(g) △H4 =+44.0kJ·mol-1 K4
则K2=_______ (用含K1、K3、K4的代数式表示)
(2)在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)十3H2(g) ![]() CH3OH(g)十H2O(g)
CH3OH(g)十H2O(g)
①下列能说明该反应已达到平衡状态的是______________________。
A.混合气体平均相对分子质量不变 B.混合气体密度不变
C.容器内压强恒定不变 D.反应速率满足以下关系:V正(CO2)=3V逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH-H键的同时形成2molH-O键
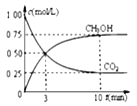
②模拟过程中测得CO2和CH3OH(g)浓度随时间变化如图所示,若此时容器内压强为P,则用平衡分压代替平衡浓度表示的化学平衡常数KP为_____________(用含P的代数式表示,数值保留两位小数),若此时再向容器内充入0.25molCO2和0.25molCH3OH的混合气体,则平衡______(填“正向“逆向“不”)移动。(已知:气体分压=气体总压×体积分数)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g) +2H2(g) ![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
(1)判断反应达到平衡状态的依据是______(填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的总物质的量不变
d.CH3OH、CO、H2的浓度都不再发生变化
(2)下图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A______C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A______C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。


(3)图I是反应时CO和CH3OH的浓度随时间的变化情况,从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=______。
(4)写出该反应的热化学方程式______________________________。
(5)当温度升高时,该平衡常数K将________(填“增大”、“减小”或“不变”)。
(6)恒容条件下,下列措施中能使![]() 增大的有______.
增大的有______.
A.升高温度 B.充入He气
C.再充入1molCO和2molH2 D.使用催化剂
(7)在恒温条件下,扩大容器体积,则平衡____(填“逆向移动”、“正向移动”、“不移动”)
查看答案和解析>>
科目: 来源: 题型:
【题目】某绿色农药结构简式为图1,回答下列问题。
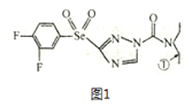
(1)基态硒原子的核外电子排布式为______________,该农药组成元素中,第一电离能较大的前三种元素是______________(按由大到小顾序排列)。
(2)分子中编号为①的碳原子和与其成键的另外几个原子构成的空间结构为____________;CSe2首次是由H2Se 和CCl4; 反应制取的,试比较上述三种分子的键角_____________(按出大到小顺序排列)。
(3)H2SeO3 分子的中心原子杂化类型是____________,试比较H2SeO3、H2SeO4 和H2SO4三种酸的酸性强弱(按由强到弱顺序排列)_______________。
(4)石墨是碳元素的一种同素异形体,石墨晶体可看作ABABA...堆积方式,晶胞结构和部分晶胞参数如图2 所示; 碱金属离子可填充在石墨层问形成石墨夹层化合物,同时堆积方式从ABABAB...变为AAAA...。
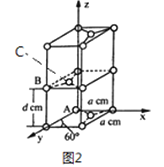
①原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B 的坐标参数分别为: A(0,0,0)、B(0,1,1/2)。则C 原子的坐标参数为_____________,。
②晶胞参数用以描述品胞的大小和形状。已知石墨晶胞底边长为a pm,层间距为d pm,阿伏加德罗常数的值为NA,则石墨的密度为_____________g/cm3 (写出表达式即可)。
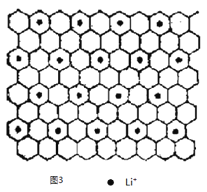
③图3为石墨夹层化合物W 的投影图,试写出W 的化学式_____________,微粒之间存在的化学键有_____________,
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 淀粉属于天然高分子化合物
B. 葡萄糖和果糖互为同分异构体
C. 油脂的主要成分是高级脂肪酸
D. 糖尿病患者的血液和尿液中含有过量的蔗糖
查看答案和解析>>
科目: 来源: 题型:
【题目】游离态碳在自然界存在形式有多种,在工业上有着重要用途。请回答下列问题:
(1)我国四大发明之一的黑火药由木炭与硫黄、硝酸钾按一定比例混合而成。黑火药爆炸时生成硫化钾、氮气和二氧化碳。其爆炸的化学方程式为_____________________________________。
(2)高级碳粉可由烃类高温分解而制得,已知几个反应的热化学方程式:
C(s)+O2(g)==CO2(g) △H1= -393.5 kJmol-1
2H2(g)+O2(g)=2H2O(1) △H2= -571.6 kJmol-1
CH4(g)+2O2(g)-=CO2(g)+ 2H2O(1) △H3= -890.3 kJmol-1
则由天然气生产高级碳粉的热化学方程式为__________________________________。
(3)活性炭可以用来净化气体和液体。
①用活性炭还原氮氧化物,可防止空气污染。向1L闭容器加入一定量的活性炭和NO,某温度下发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
物质的量/mol 时间/min | NO | N2 | CO2 |
0 | 0.200 | 0 | 0 |
10 | 0.116 | 0.042 | 0.042 |
20 | 0.080 | 0.060 | 0.060 |
30 | 0.080 | 0.060 | 0.060 |
此温度下,该反应的平衡常数K=________(保留两位小数)。10-20min内,NO的平均反应速率为_______________;若30min后升高温度,达到新平衡时,容器中c(NO)∶c(N2) ∶c(CO2)=2∶1∶1,则该反应的ΔH________0(填“>”、“<”或“=”)。
②活性炭和铁屑混合可用于处理水中污染物。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示。当混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是_________________;当混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是___________________________。
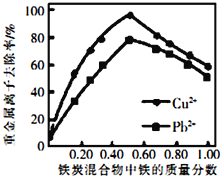
查看答案和解析>>
科目: 来源: 题型:
【题目】亚铁氰化钾的化学式为K4Fe(CN)6,一种用含NaCN废水合成该化合物的主要工艺流程如下:
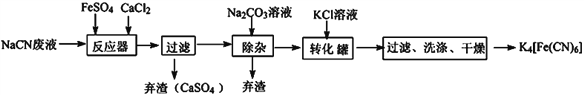
(1)请依据工艺流程图中的信息,回答下列问题:
①在“除杂”步骤中弃渣的主要成分为__________________(填化学式)。
②在“反应器“中发生的主要反应的化学方程式为:________________________________;
③相同温度下溶解度:Na4[Fe(CN)6]________K4[Fe(CN)6] (选填“>”、“<”或“=”)
(2)氰化钠(NaCN)是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。NaCN 的电子式为__________________________;实验室用NaCN固体配制NaCN溶液时,应先将其溶于氢氧化钠溶液中,再用蒸馏水稀释。NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是______________________________________。
(3)已知:氢氰酸是一种有苦杏仁气味的无色剧毒液体,易挥发,25℃时,Ka(HCN)=6.25×10-10。
①处理含CN-废水的方法是:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN-;第二步控制pH为7.5-8.5,用NaClO完全氧化OCN-生成N2和两种盐。
请写出第二步反应的离子方程式:_________________________________________。
②反应CN-+H2O![]() HCN+OH-在25℃时的平衡常数K=_____________(填数值)。
HCN+OH-在25℃时的平衡常数K=_____________(填数值)。
(4)K4Fe(CN)6与高锰酸钾溶液反应,其方程式为:
K4Fe(CN)6+KMnO4 +H2SO4=KHSO4+Fe2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平), 若有1mol K4Fe(CN)6被高锰酸钾氧化时,则消耗KMnO4的物质的量为________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com