
科目: 来源: 题型:
【题目】镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用。
(1)Ni在元素周期表中的位置是_____,其价电子层中有_______个未成对电子。
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+等。
①Ni(CO)4熔点为-19.3℃,沸点43℃,则其熔、沸点较低的原因是_____________。
②其分子中σ键与π键数目之比为_____________________。
③写出一种与配体CO互为等电子体的阴离子符号_____________________。
④[Ni(NH3)6]2+中配体NH3中N原子的杂化类型为_______________,若[Ni(NH3)6]2+为正八面体构型,则[Ni(CO)2(NH3)4]2+的结构有________________种。
(3)金属Ni与富勒烯(C60)可制备一种低温超导材料,晶胞如图所示, Ni 原子位于晶胞的棱上与内部,该超导材料的化学式为____。
(4)NiO的晶体结构与氯化钠的晶体结构相同。将NiO晶体在氧气中加热,部分Ni2+被氧化为Ni3+,晶体结构产生镍离子缺位的缺陷,其组成为Ni0.97O,但晶体仍保持电中性,则晶体中Ni2+与Ni3+离子的数目之比为______;若阿伏加德罗常数的值为NA,晶体密度为d g·cm-3,则该晶胞中最近的O2-之间的距离为_______________pm。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. Na2CO3溶液显碱性,NaHCO3溶液显酸性
B. 可用加热方法除去NaHCO3固体中的Na2CO3杂质
C. 用Ba(OH)2溶液能鉴别碳酸钠和碳酸氢钠溶液
D. 等质量的Na2CO3、NaHCO3固体分别与足量盐酸反应,后者产生的CO2多
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组做以下属于对SO2的性质进行研究。请回答下列问题:
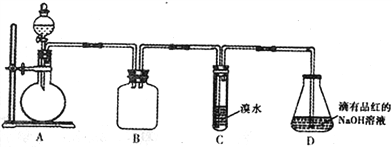
(1)装置B的作用是_______________________。
(2)装置C的目的是检验SO2的_____性。装置D中NaOH全部转化为NaHSO3的标志是_______________。
(3)请设计简单实验证明:室温下,NaHSO3溶液中HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小关系_______________________________。
(4)向装置D所得NaHSO3溶液中加入NaClO溶液时,反应有下列三种可能的情况:
Ⅰ.HSO3-与ClO-恰好反应 Ⅱ. NaClO不足 Ⅲ. NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HClO)
实验序号 | 实验操作 | 现象 | 结论 |
① | 加入几小块CaCO3固体 | 有气泡产生 | Ⅰ或Ⅱ |
② | 滴加少量淀粉KI溶液,振荡 | __________ | Ⅲ |
③ | 滴加少量溴水,振荡 | _________ | Ⅱ |
④ | 滴加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | ______ |
(5)测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2 +2H2O==H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为_________g·L-1。
②在上述实验过程中,若有部分HI 被空气氧化,则测得结果________(填“偏高”、偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是()
A.Al2O3熔点高,可用作耐高温材料
B.NH4HCO3受热易分解,可用作氮肥
C.Fe2(SO4)3易溶于水,可用作净水剂
D.SO2具有氧化性,可用于漂白纸浆
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z 是三种短周期元素,其中 X、Y 位于同一主族,Y、Z 处于同一周期,X 原子的最外层电子排布式是 2s22p4,Z 原子的核外电子数比 Y 原子少 1。下列说法不正确的是( )
A. CX2(C 是原子核内含 6 个质子的元素)分子是非极性分子
B. ZH3 的 VSEPR 模型名称为三角锥形
C. Z4 分子是非极性分子
D. 酸 H2YO4 比酸 H3ZO4 的酸性强
查看答案和解析>>
科目: 来源: 题型:
【题目】把7.4 g Na2CO3·10H2O 和 NaHCO3组成的混合物溶于水配成100mL溶液,其中c(Na+)=0.6mol/L。若把等质量的混合物加热至恒重,残留物的质量是
A. 5.28g B. 2.12g C. 4.22g D. 3.18g
查看答案和解析>>
科目: 来源: 题型:
【题目】根据以下几个反应:
①Cl2+2KI===2KCl+I2 ②2FeCl2+Cl2===2FeCl3
③2FeCl3+2KI===2FeCl2+2KCl+I2
④I2+SO2+2H2O===H2SO4+2HI
判断氧化性由强到弱的顺序是
A. Cl2>I2>Fe3+>SO2 B. Cl2>Fe3+>I2>SO2
C. Cl2>Fe3+>SO2>I2 D. Fe3+>I2>Cl2>SO2
查看答案和解析>>
科目: 来源: 题型:
【题目】ⅣA、ⅤA、ⅥA、ⅦA 四个主族元素的氢化物的沸点变化趋势如下图所示,分析图中的递变规律,下列结论中正确的是( )

A. CH4 分子间的氢键较弱,故其沸点较低
B. 图中的横坐标的数值表示的是中心原子的主族序数
C. ⅣA 族元素氢化物的稳定性随相对分子质量的递增逐渐增强
D. H2O、HF、NH3 三种物质的沸点比同主族的其他氢化物都高,是因 为组成这三种物质的分子间均可形成氢键
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种理想的清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)直接热分解法制氢。某温度下,H2O(g)![]() H2(g)+
H2(g)+![]() O2(g)。该反应的平衡常数表达式为K=_____。
O2(g)。该反应的平衡常数表达式为K=_____。
(2)乙醇水蒸气重整制氢。其部分反应过程和反应的平衡常数随温度变化曲线如图1所示:

反应中,某温度下每生成1mol H2(g) 热量变化是62 kJ。则该温度下图1所示反应的热化学方程式是______________________________________。
(3)水煤气法制氢。CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH <0,在进气比[n(CO)∶n(H2O)]不同时,测得相应的CO的平衡转化率见图2(各点对应的反应温度可能相同,也可能不同)。
CO2(g)+H2(g) ΔH <0,在进气比[n(CO)∶n(H2O)]不同时,测得相应的CO的平衡转化率见图2(各点对应的反应温度可能相同,也可能不同)。

①往维持恒温的2L密闭容器中加入一定量的CO和0.lmol H2O(g),在图中G点对应温度下反应经5min 达到平衡,则v(CO) 等于_________mol/(L·min)
②图中B、E 两点对应的反应温度分别为TB和TE判断:TB______TE (填“<”“=”或“>”)。
③经分析,A、E 和G三点对应的反应温度都相同为T℃,其原因是A、E 和G三点对应的_____________相同。
④当T℃时,若向一容积可变的密闭容器中同时充入3.0 mol CO、1.0 mol H2O、1.0mol CO2和x mol H2,要使上述反应开始时向正反应方向进行,则x应满足的条件是_________________________________。
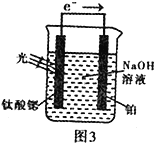
(4)光电化学分解制氢。其原理如图3,钛酸锶光电极的电极反应为:4OH--4e-![]() O2+2H2O
O2+2H2O
则铂电极的电极反应为_______________________________。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成Mg2Cu和仅含一种金属元素的氢化物(其中氢的质量分数约为0.077)。Mg2Cu与H2反应的化学方程式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p轨道电子数比s轨道电子数少1,C为金属元素且原子核外p轨道电子数和s轨道电子数相等,D元素的原子核外所有p轨道全充满或半充满。
(1)写出四种元素的元素符号:A_______,B_______,C_______,D_______。
(2)写出C、D两种基态原子核外电子排布图:
C________________________________________________________________________;
D________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com